Als wir unseren Vater zu seiner Forschungsarbeit befragten, kam zum Ausdruck, dass er sich mit verschiedenen Fragen befasste, die jedoch alle aus der täglichen Arbeit für seine Patienten entsprangen. Er berichtete über eine durch die Deutsche Forschungsgemeinschaft (= DFG) gesponserte Laborarbeit zur Untersuchung eines Verfahrens, mit dem Neuroblastome (=Tumore der Nebenniere, die häufigste bösartige Tumorkrankheit im Kindesalter), neben der Operation erfolgreicher behandelt werden könnten. Das Präparat, das wir für diese Studie verwendeten war das Lovastatin, ein Kohlenhydrat, das zur Behandlung von Hypercholesterinämien verwendet wird. An dieser Stelle die Biochemie des Lovastatins zu beschreiben würde den Rahmen sprengen. Wesentlich ist, dass wir in unserem Labor mit dem Biochemiker Dr. Girgert, meiner Doktorandin Mona Lenze und der hochintelligenten Laborantin Vanessa zusammen herausfanden, dass Lovastatin das Wachstum von manchen Neuroblastom-Zell-Linien hemmen kann. Es hemmte die Entwicklung von Tumor-Zell-Membranen mancher Neuroblastome. Dabei spielt das Protein p21 eine Rolle, das bei Neuroblastomen vermehrt exprimiert wird. Diese Expression konnte durch Lovastatin gehemmt werden. Wenn nun das Gen, welches das Protein p21 codiert, mutiert, entsteht das sog. p 21-ras-Protein, wodurch die Hemmung blockiert und die Proliferationsrate der Zellen pathologisch vermehrt wird. D. h.: Es entsteht ein Tumor.
Lovastatin konnte die Proliferation um rund 3O-40 % hemmen. Es zeigte sich, dass p21 in den Zellmembranen als Tumorsuppressor wirkt, der die Produktion des Proteins p-23 negativ beeinflusst, was DNA-Schäden verhindern kann.
Fazit: (eines Laien): Wenn das Gen für das Protein p23 mutiert, führt es nicht mehr zur Apoptose eines geschädigten Proteins und damit einer Zelle, sondern über das p23 zur Tumorbildung.
Eine andere Laborarbeit: Schweizer führte zusammen mit seinem Doktoranden Kirschner die Kultivierung von Leberzellen in Kulturmedien durch. Sie konnten nachweisen, dass aus wenigen Leberzellen in einem Kulturmedium binnen 14 Tagen Netze und Platten von Leberzellen entstanden. Diese Arbeit sollte ein Beitrag zur Therapie von Lebertumoren sein, die ausgedehnte Resektionen der Leber forderten.
Ein drittes Forschungsthema entstand buchstäblich Zufall. Es wird hier unter dem Titel Erstes Beispiel erwähnt. Als dieses Thema auftauchte, war Schweizer nach seiner Zeit als Medizinalassistent am Krankenhaus Tettnang schon seit zwei Jahren Assistent in der Abteilung für Kinderchirurgie in Tübingen. Der Zufall führte nun zu einem zentralen Teil von Schweizers Forschung.
Erstes Beispiel:
Die Extrahepatische Gallengangsatresie (=EHGA) und die Entwicklung eines neuen Operationsverfahrens
Im Interview berichtete uns unsere Vater die Geschichte, wie es zu dieser Entwicklung kam:
An jedem Freitag fand in der Tübinger Kinderklinik eine Vistite der Kinderärzte und der Kinderchirurgen statt. An einem dieser Freitage stellte der Ärztliche Direktor der Kinderklinik, Prof. Dr. Bierich, uns Kinderchirurgen ein neun Wochen altes, quittengelbes Kind (Abb. 1) vor, das nach den Worten ausdiagnostiziert war. Die Ärzte der Kinderklinik hatten ausgiebige Anamesen und Labordiagnostik durchgeführt, jedoch keinen Hinweis auf die Ursache der Krankheit bekommen. Sein Chef, Prof. Dr. Andreas Flach und Prof. Dr. Bierich, der Chef der Kinderklinik, beauftragten mich und einen jungen Pädiater, das Kind nochmals gründlich zu untersuchen, während sie Beide die Visite durchführten. Wir beide jungen Assistenzärzte schauten nochmals alle bisher durchgeführten Untersuchungsergebnisse durch, fanden aber außer dem Ikterus keinen pathologischen Befund.
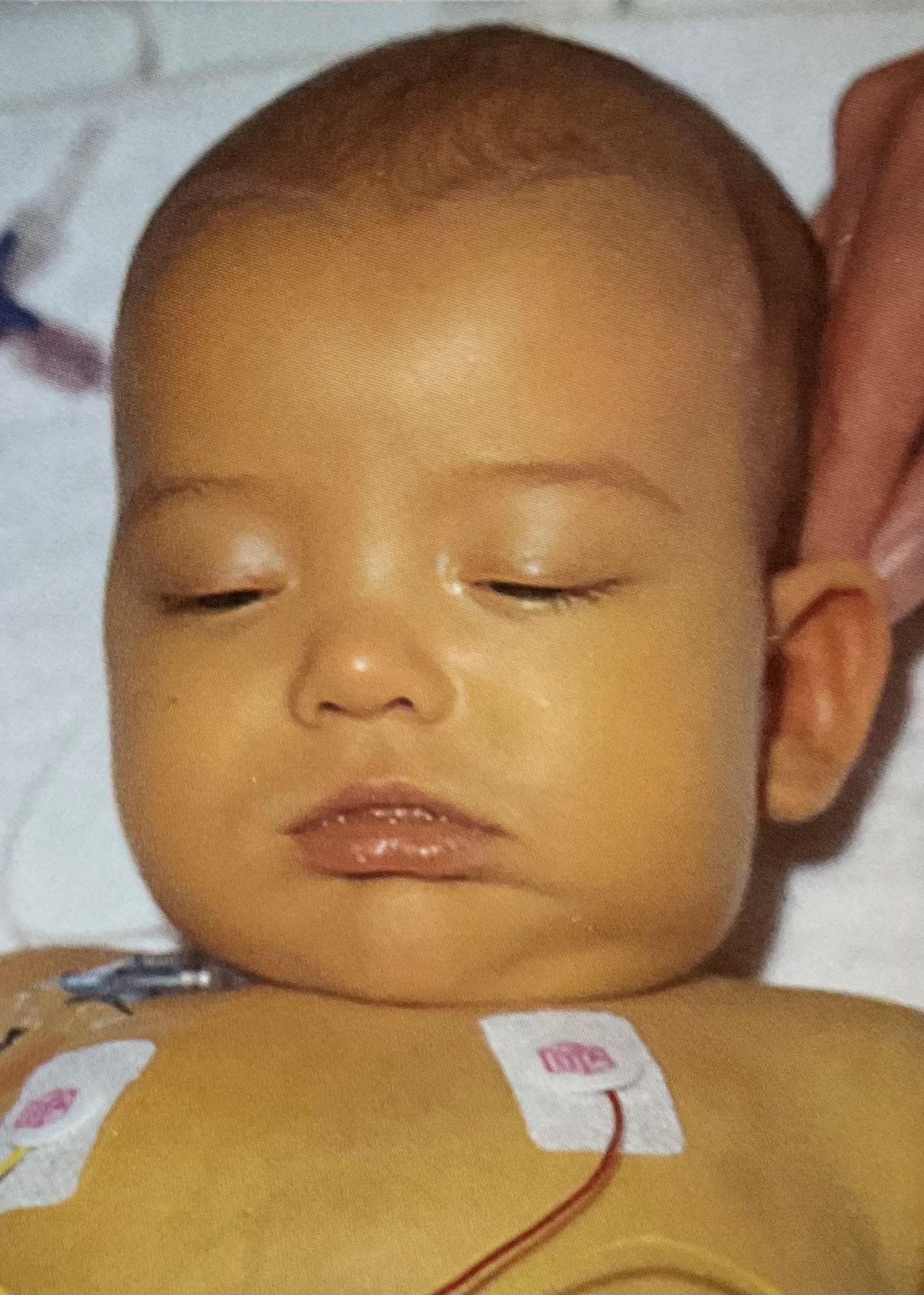
Als wir das Kind von seinen Windeln befreiten bemerkte unser Vater dabei einen entfärbten Stuhl, der ihm den Hinweis auf den Ikterus gab, den man dem Kind aber schon an der Haut und an den gelben Augen ablesen konnte. Dann tastete er seinen aufgeblähten Bauch ab und fand eine relativ harte und etwas höckerige, vergrößerte Leber. Zudem war freie Flüssigkeit in der Bauchhöhle zu erkennen.
Nun kam das Momentum, das mich sofort an eine englischsprachige Schrift aus Boston erinnerte, die ich am Samstag in der Woche davor gelesen hatte. Er war überzeugt, dass das Kind eine Gallengangsatresie haben muss. (An diesem Punkt angekommen muss darauf hingewiesen werden, dass die Kinderklinik damals noch kein Sonografiegerät besaß). Also konnte nur eine Leberbiopsie die Verdachtsdiagnose klären. Im Moment, als der junge Assistenzarzt der Kinderklink fragte, was denn eine Gallengangsatresie sei, kamen die beiden Professoren von der Visite zurück. Ich berichtete ihnen, dass sowohl die Anamese, das Alter des Kindes sowie der typische Stuhl und Tastbefund für eine Extrahepatische Gallengangsatresie sprechen, sodass die Diagnose nur mit einer Leberbiopsie bewiesen werden kann. Prof. Bierich sagte sofort (wort-wörtlich): Machen sie das! Schweizer ging an das nächste Telefon und telefonierte mit dem Pathologen Prof. Günter Müller, der anerkannter Hepatologe war und später Leiter der Pathologie in Chur/CH wurde. Er hatte das Besteck, das man für eine Leberpunktion benötigt und kam, ohne zu zögern, in die Kinderklinik. Unter seiner Aufsicht führte mein Vater seine erste Leberpunktion durch (wie er uns danach gestand). Der Pathologe nahm das Präparat mit und versprach, es unmittelbar unterm Mikroskop zu untersuchen.
(Mit Prof. Müller arbeitete Schweizer in Zukunft engmaschig zusammen. Sie wurden sogar Freunde und publizierten zusammen mehrere Schriften über die histologischen Befunde der Gallengangsatresie).
Die Ärzt:innen der Kinderklinik hatten sich inzwischen schon zur Konferenz zusammengesetzt, die nach jeder Freitags-Visite stattfand. Als ich den Hörsaal betrat, unterbrach Prof. Bierich die Konferenz abrupt und sagte wort-wörtlich: So, Kollege, nun haben sie einen eigenen Patienten, was hieß, dass mein Vater sich nun um dieses Kind zu kümmern habe. Zudem forderte er ihn auf, spontan mit einem Vortrag über das Krankheitsbild der Gallengangsatresie zur Fortbildung der Ärzte zu beginnen. Was ihn nun wunderte war, dass nur zwei von 11 Assistenten der Kinderklinik mit der Diagnose etwas anfangen konnten. Sogar die beiden Professoren und mehrere Oberärzte kannten das Krankheitsbild kaum, oder gar nicht.
Am Tag danach rief ihn der Pathologe Müller an und bestätigte ihm seine Diagnose. Er ging erneut in die Kinderklinik, um mit dem Stationsarzt über das weitere Vorgehen zu sprechen. Zusammen sprachen sie nun über therapeutische und prognostische Möglichkeiten, fanden jedoch keine Lösung, denn Kinder mit einer Gallengangsatresie galten damals noch als irreparabel. Der Mutter konnte mein Vater leider auch keine großen Hoffnungen machen und zog sich schließlich auf den Hinweis zurück, dass er sich über das Wochenende gründlich informieren werde.
Am Wochenende stöberte Schweizer in der Klinik-Bücherei Bücher und Schriften durch, die ihn ergiebig über die Krankheit informieren sollten. Er fand schließlich eine Schrift aus der Feder des früheren Direktors der Chirurgischen Klinik, des Prof. und Hofrats Dick, der eine Methode beschrieb, wie man bei erwachsenen Patienten mit einem Gallestau Abhilfe schaffen wollte (aber nicht konnte). Also ging ich zu Prof. Dick, der damals noch in Tübingen wohnte. Dick machte mir jedoch wenig Hoffnungen auf einen Erfolg, denn er berichtete mir, dass er bei erwachsenen Patienten mit einem Gallestau aus anderer Ursache eine breite Kerbe in die Leber geschnitten und in diese Wunde eine Darmschlinge anastomosiert habe. Dann ging Dick in seine Hausbibliothek und brachte ein paar Schriften mit, die ähnliche Verfahren anboten. Die Ergebnisse waren aber durchgehend fatal, sodass er sie auf gar keinen Fall empfahl.
(Das pure Mitleid mit Mutter und Kind, nicht die Ratio, war der Antrieb für diese Entscheidung, sagte unser Vater).
Als ich den Vorschlag gemacht hatte, das Kind zu laparotomieren, zeigte Bierich mit seinem Zeigefinger auf mich und sagte: Operiere das Kind so bald wie möglich. Ich schaute erschrocken meinen Chef, Prof. Flach an, aber er stimmte dieser Aufforderung bedingungslos zu. (Später sagte er mir, dass man spüren konnte, wie sehr dich Bierich schätzt.)
Die Operation:
Um keine Zeit zu verlieren organisierte Schweizer noch in der selben Nacht eine Laparotomie. Die Op-Schwestern stimmten zu. Er präparierte die Leberpforte auf und suchte einen Gallengang. Zwischen Duodenum und Leberpforte fand er nur einen harten fibrösen Strang, der mit der Umgebung bindegewebig verwachsen war. Alle Versuche, in diesem festen, soliden Strang ein Lumen zu finden, brachten keinen Erfolg. Schließlich löste er den Strang aus seinen Verwachsungen in der Leberpforte, weil er hoffte, dort auf gestaute Gallengänge zu stoßen. Als er eine breite Kerbe in die Leber hinein präpariert hatte und rechts und links des Strangs an die Lebergefäße stieß (Abb.2), verließ in der Mut. Um die Kerbe aber zu schließen bildete er aus einer Dünndarmschlinge intuitiv eine Anastomose mit der Kerbe als
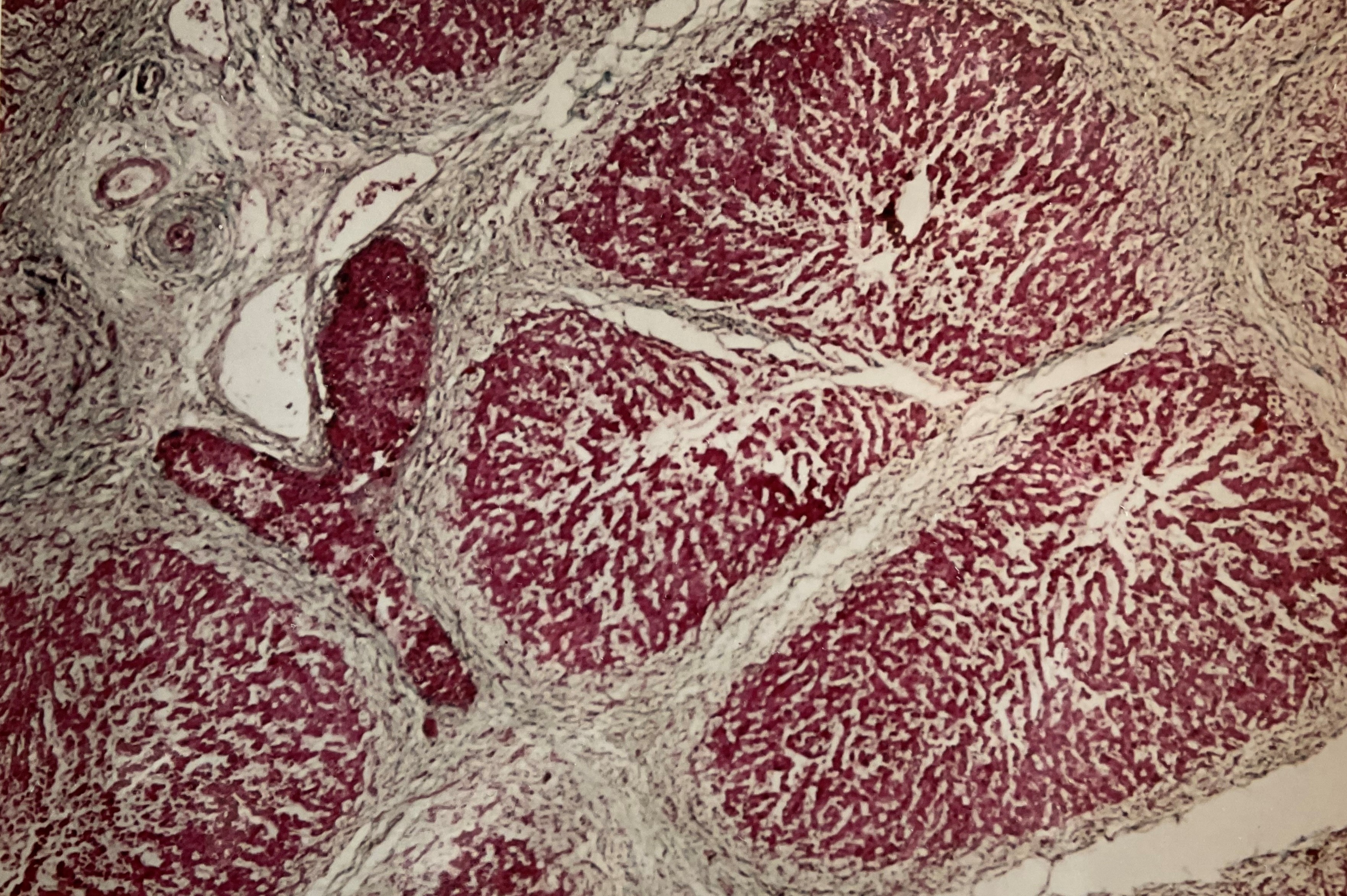
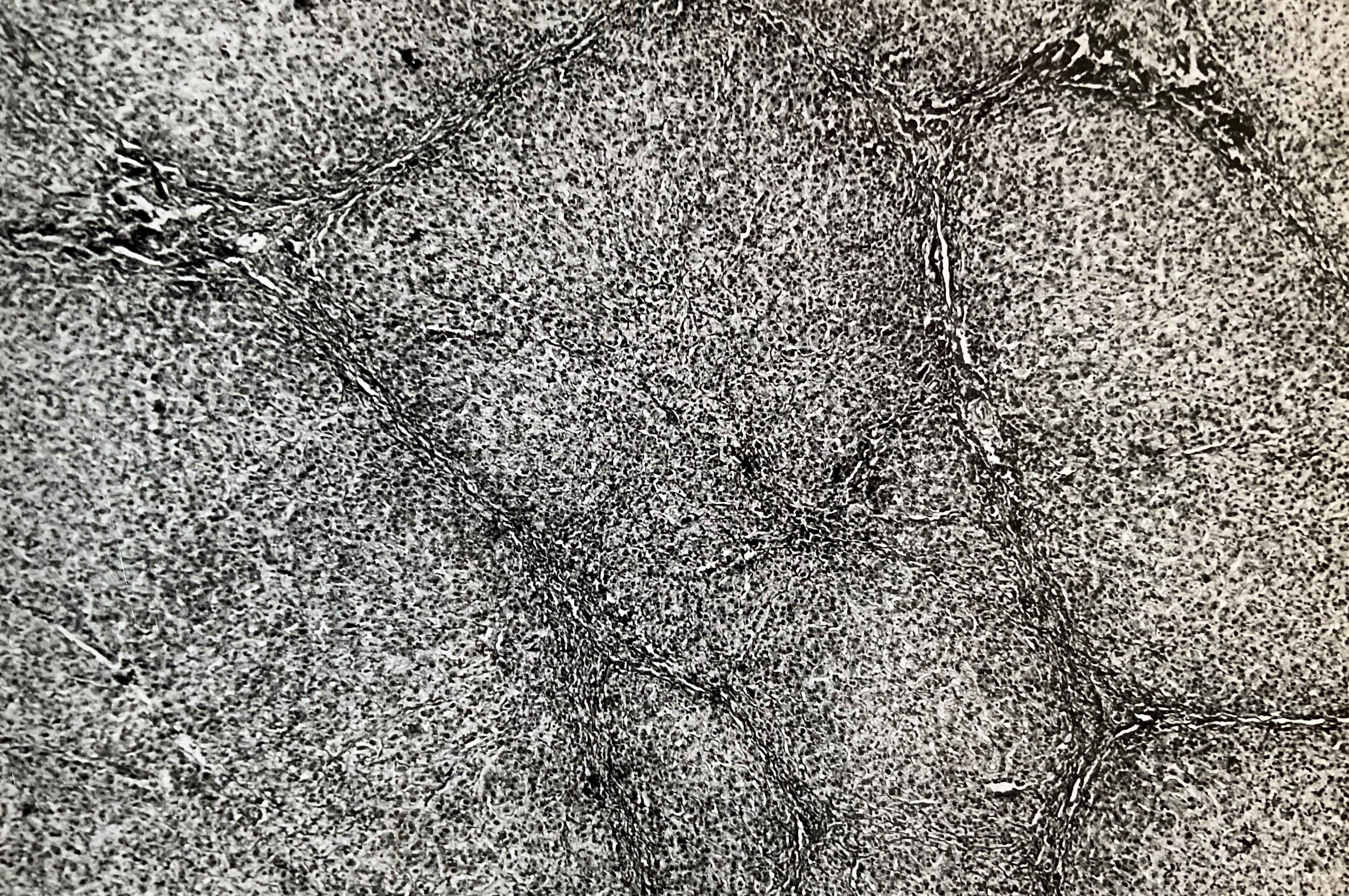
Neogallengang. Das Leberpräparat brachte er am nächsten Morgen persönlich in die Pathologie und der Pathologe Müller rief ihn schon am Abend an und berichtete, dass er in dem Leberpräparat sehr dünne Gallengangsformationen sehen kann, die jedoch bestenfalls einen Durchmesser von ca. 0,03 mm haben. Er demonstrierte Schweizer den Befund am Mikroskop. (Abb. 3a/ 3b)
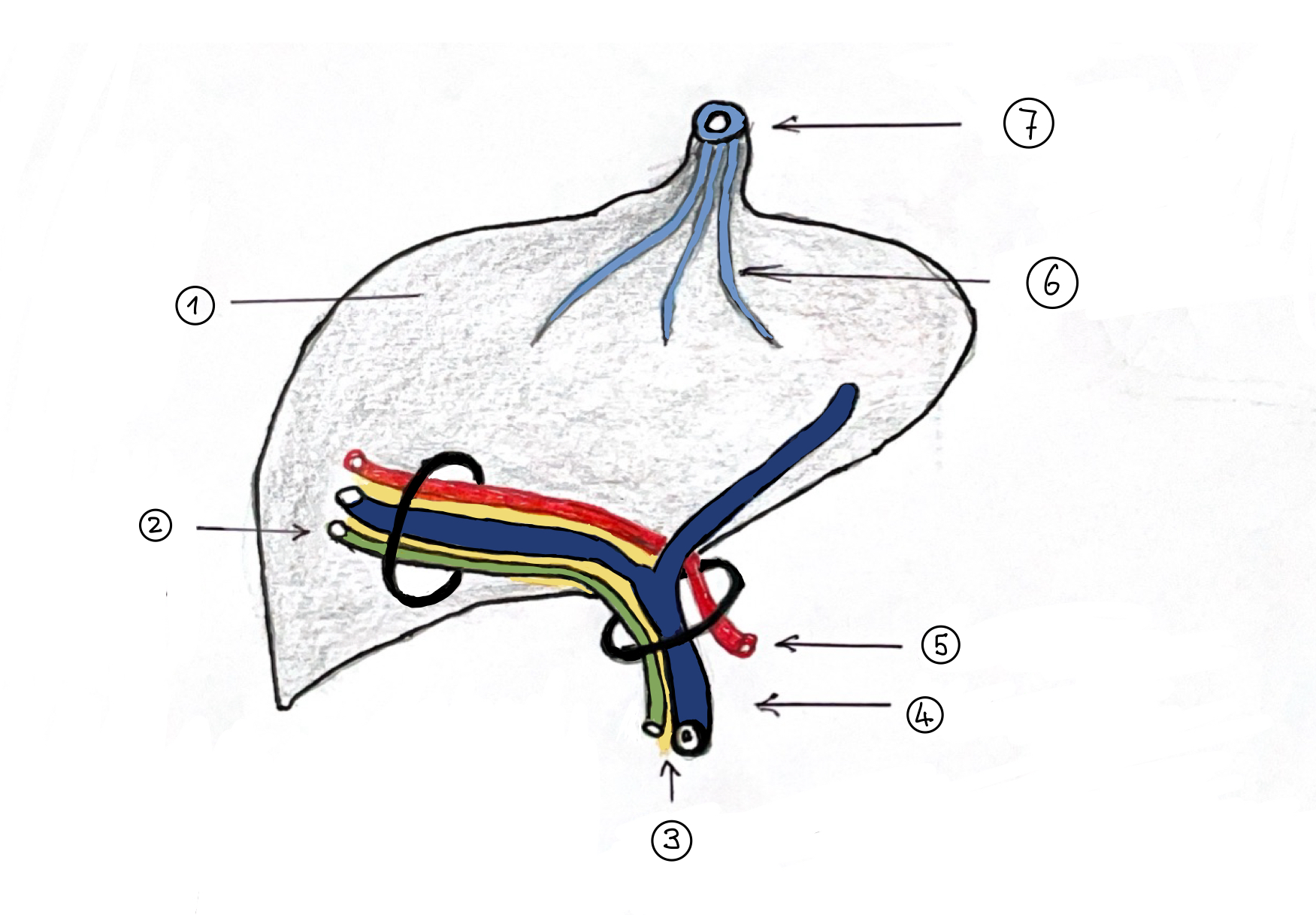
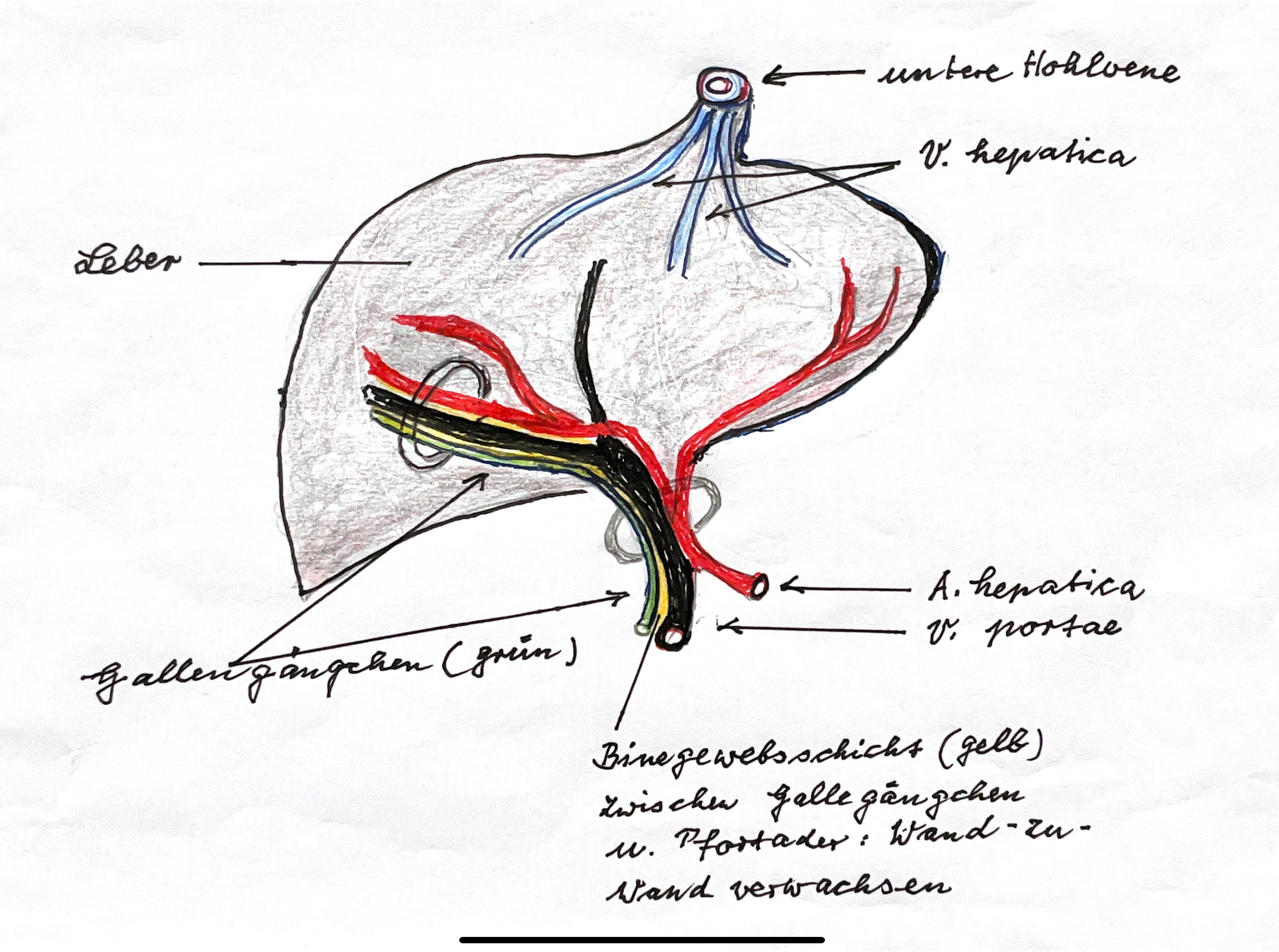
((Abb.2) Sie zeigt schematisch die Konfluenz der Pfortader im Eintritt in die Leber und den gegenläufigen, normalen Verlauf der intrahepatischen Gallengängchen entlang den beiden Pfortaderästen: (Pfortader: violett, Gallengängchen: grün, Bindegewebe: gelb). Solche intrahepatischen Gallengängchen sind, (sofern sie überhaupt vorhanden sind), fest mit der gegenläufig verlaufenden Wand der Pfortader verbunden.)
 (Abb. 3b)
(Abb. 3b)
((Abb. 3a) und (Abb. 3b) Ein Präparat aus der Leberpforte, direkt an der Wand des Pfortaderastes entnommen. Die intrahepatischen Gallengängchen sind weißlich gefärbt, sichtbar in den Leberläppchen-Wänden.
„Dieses Präparat fertigte ich selbst im Labor der Kinderklinik auf der Bult in Hannover an, wurde jedoch vom Pathologen Müller in Chur begutachtet“.)
Die folgenden Tage hatte mein Vater kein gutes Gefühl, schlief schlecht und schaute täglich 2-3 mal nach seinem kleinen Patienten. =>Fünf Tage später zeigte ihm der pädiatrische Assistenzarzt eine Windel, die spärlich grün-bräunlich aussah (Abb. 4).
 (Abb. 4)
(Abb. 4)Stuhlproben
Die Stühle wurden in Gefäßen gesammelt, um im zeitlichen Verlauf die Stuhlfärbung beurteilen zu können.
Am 7. Tag berichtete mir der Assistent aus der Kinderklinik, dass der Bilirubinwert sinkt. Nach zwei Wochen war er von 12 mg/dl auf 2,0 mg/dl gefallen, das Gesicht des Kindes entfärbte sich zunehmend.

des Kindes aus der Klinik.)
Nun drängten mich der Chef der Kinderklinik, Prof Bierich, und mein eigener Chef, Prof. Flach, dazu, dass ich mich mit der seltenen Krankheit Gallengangsatresie wissenschaftlich beschäftigen soll. Nach wenigen Tagen legte ich ihnen ein Programm vor, das 2 unterschiedliche Untersuchungen nannte. (1.) Der Pathologe Müller hatte 15 Lebern von Kindern in seiner Vitrine, die aus anderen Ursachen gestorben waren. An diesen Lebern ließ er mich Untersuchungen über den Verlauf der intrahepatischen Gallengänge durchführen“. (2.) Ich schnitt 5 frischgeborenen Schweinchen in Narkose die intrahepatischen Gallengänge aus der Leberpforte, ließ sie einen Ikterus entwickeln und stellte den Gallefluss nach 10 Tagen wieder durch eine Hepato-Porto-Jejunostomie her. (Ich kann zu meiner eigenen Entlastung erwähnen, dass alle 5 Schweinchen die Torturen überlebt haben).
(Abb. 6)
Schematische Darstellung Leber mit Gallengängchen, Bindgewebe, Pfortader
(Als Ergebnis zeigte sich, dass die intrahepatischen Gallengängchen sehr eng, Wand an Wand, durch (üppiges) Bindegewebe mit dem begleitenden Gefäß der Pfortader verwachsen sind. Aus diesen bindegewebigen Verwachsungen waren sie nur sehr schwierig zu lösen, zumal die Bindegewebsschicht zwischen der Wand des Pfortaderastes und der Wand der Gallegängchen nur maximal 0,5 mm breit war. Zudem nahmen sie keinen Verlauf in die Mitte der Leberpforte, sondern verließen die Leber gegenläufig, parallel zu den in die Leber eintretenden Pfortadergefäßen, welche die Leberpforte rechts und links begrenzen. Es musste angenommen werden, dass sie bei einer Gallengangsatresie zusammen mit dem extrahepatischen Gallengang in der Leberpforte veröden, denn ein Austritt konnte bei Kindern mit einer Gallengangsatresie nie nachgewiesen werden. (Ich vermutete hinter dieser Beobachtung, dass überschüssiges Bindegewebe um die Gallengängchen eine embryonale Ursache in der Entstehung der Gallengangsatresie haben könnte).
Die Präsentation dieses Befundes auf einem Kongress in Darmstadt brachte Kirschner und mir den 1. Posterpreis). Zudem demonstrierte die histologische Untersuchung der entfernten distalen Gallengangssegmente von Patienten mit einer Gallengangsatresie, dass die Gallengängchen kein Lumen hatten, sondern in diesen Abschnitten (sekundär narbig ) verödet waren“. (Reste von Schleimhautzellen in den Strängen können diese Vermutung unterstützen und erklären, dass die Atresie per se eine sekundäre Genese hat, nicht genetisch verursacht wird. Zu diesen, der Pfortader gegenläufig entlang verlaufenden intrahepatischen Gallengängchen, gab es noch 1 bis maximal 3 rudimentäre Gallengängchen, die im Zentrum der Leber entsprangen und direkt in die Mitte der Leberpforte verlaufen“ (Abb. 7)
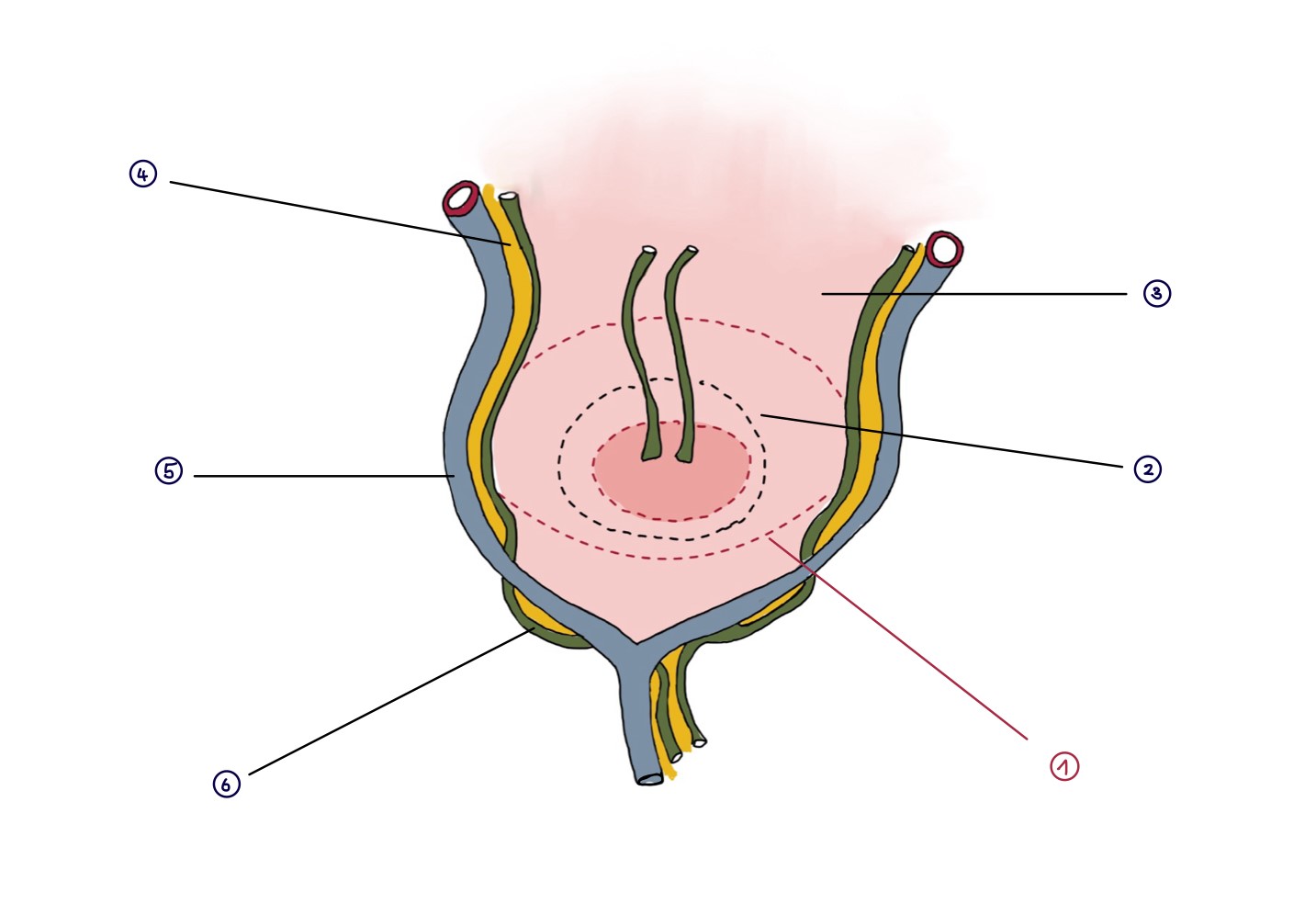
(Abb. 7)
(Schematische Darstellung von intrahepatischen Gallengänchen, die zum Teil in der Leber bis zur Mitte der Leberpforte verlaufen und zum Teil auch entlang der Pfortaderäste verlaufen.)
1. Präperationslinie nach Schweizer
2. Präperationslinie nach Kasai
3. Leber
4. gelb: Bindegewebe
5. blau: Pfortaderast
6. grün: Gallengängchen
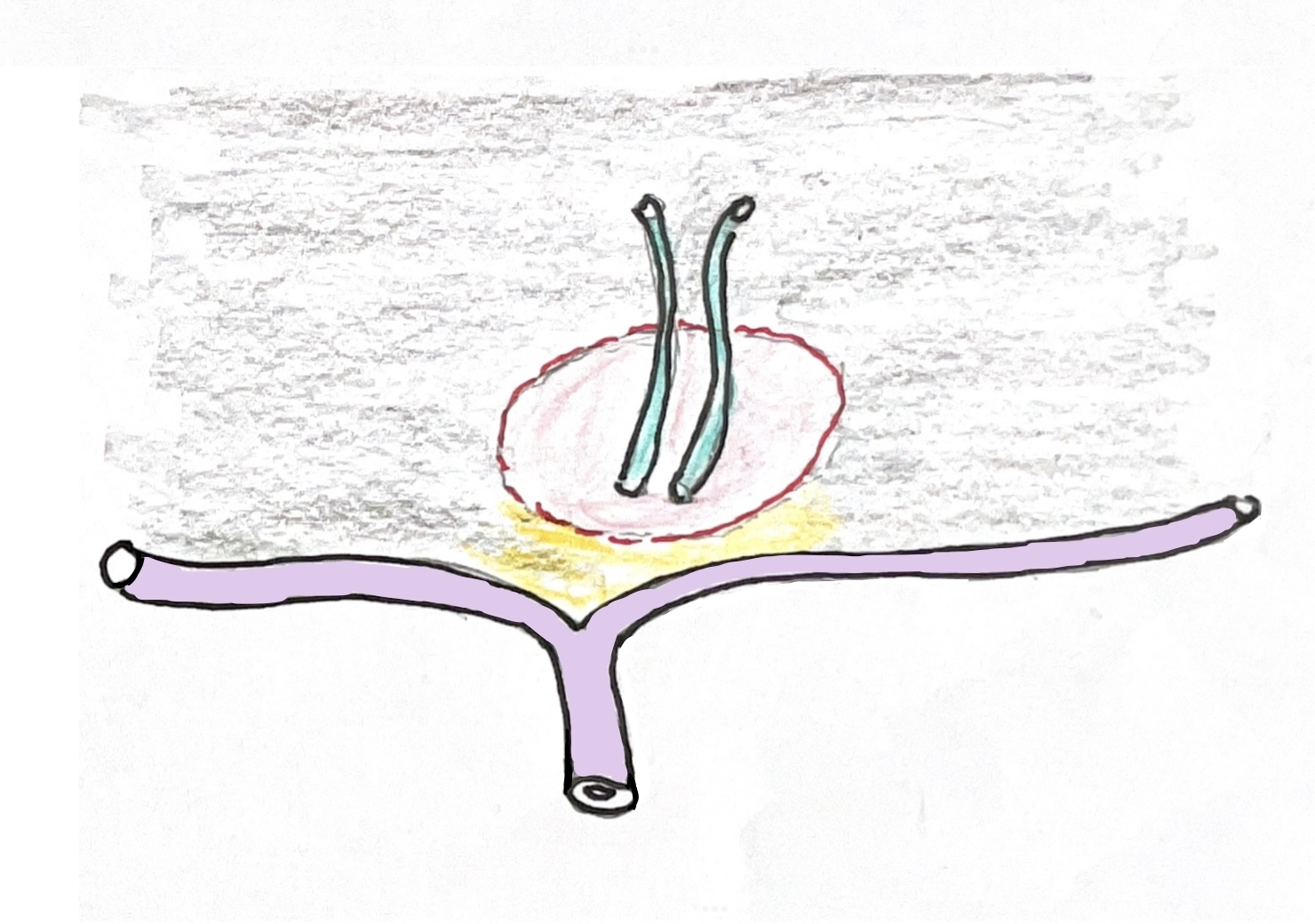 (Abb. 7a)
(Abb. 7a)
(Abb. 7a Morio Kasai)
Die vom japanischen Chirurgen Morio Kasai inaugurierte Hepatoporto-Jejunostomie bei Extra-Hepatischer Gallengangsatresie erfasst die lateral mit der Pfortaderästen verlaufenden Gallengängchen nicht, weil die Präparation der Leberpforte nicht breit genug erfolgt. Daher können nur Gallengängchen erfasst werden, die eventuell in der Mitte der Leberpforte münden.
(Der Vorteil der Operation nach Kasai ist aber im Vergleich zur Extendit-Hepatoporto-Jejunostomie nach Schweizer, dass sie weniger riskant (not so risky) ist (wie Kasai bei einem Kongress in Berlin sagte, weil das Risiko der Verletzung der Pfortaderäste birgt).
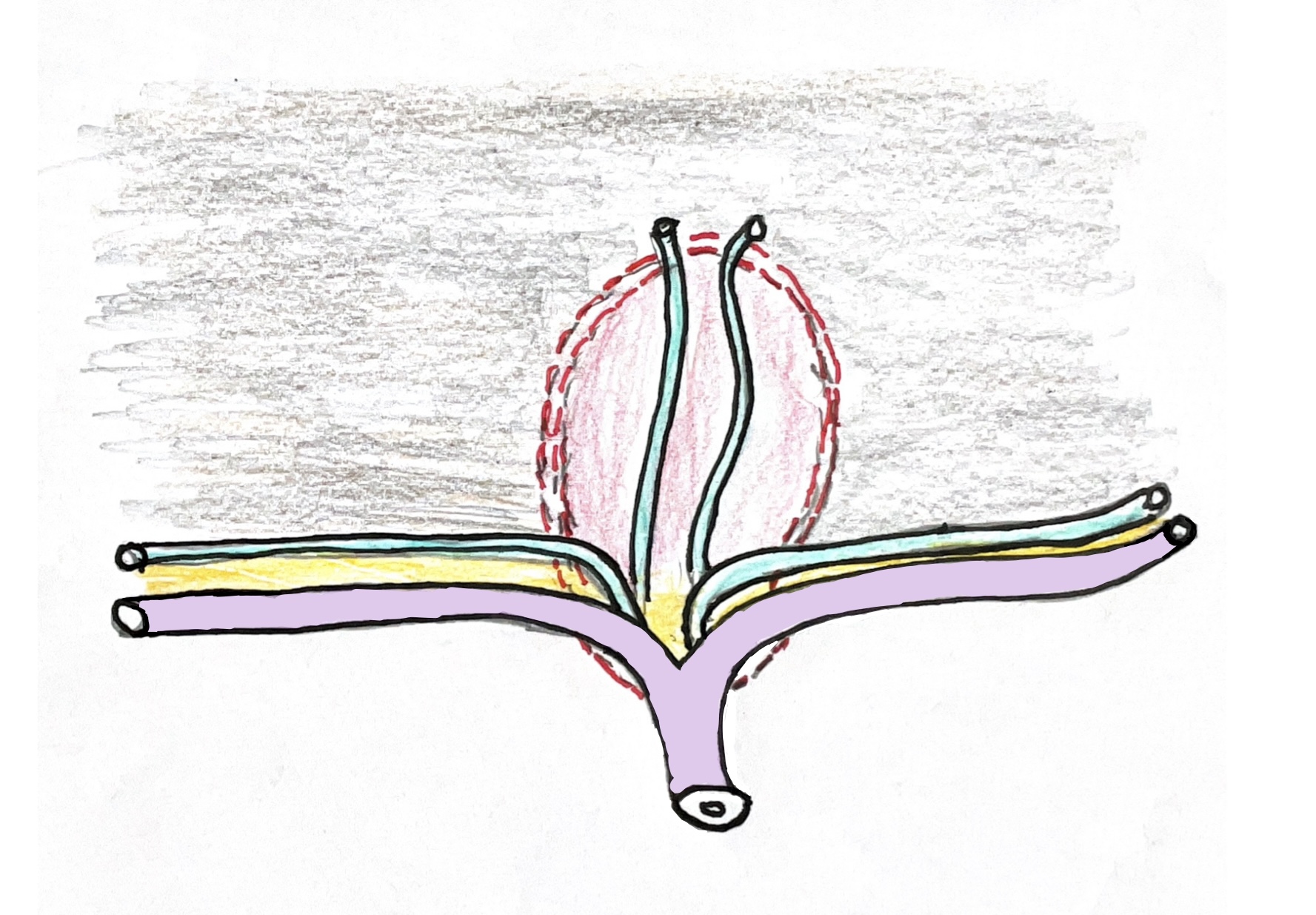 (Abb. 7b)
(Abb. 7b)
(Abb. 7b Paul Schweizer)
Extendit-Hepatoporto-Enterostomie: Das gelbgefärbte Bindegewebe fixiert die Wand von intraheatischen Gallengängchen fest auf der Wand des intraheptischen Anteils der Pfortader. Bei einer Extra-Hepatischen Gallengangsatresie enden intrahepatische Gallengängchen (sofern sie überhaupt vorhanden sind) im festen Bindegewebe beim Verlassen des Pfortaderastes in der bindegewebig veränderten Leberpforte. Anatomisch wir dieser Ort als Konfluenz der intrahepatischen Gallengänge bezeichnet. Dieser Konfluenz kann operativ aber nur gefasst werden, wenn die Präparationslinie in der Leberporte bis zu den Pfortaderästen an der linken und rechten Seite ausgedeht wird (siehe: rotgestichelte Linie). Die Präparation zur Erkennung von Gallengängchen muss daher breit sein, um die Gallengängchen erfassen und mit einem Neogallengang, der aus einer ausgeschalteten Jejunumschlinge gebildet wird, zu anastomosieren. Mit einer derart breiten Päperation der Leberpforte können vorhandene Gallengängchen bei mirkroskopischer Operationstechnik gefunden werden, sofern sie vorhanden sind.
(Zusätzlich können auch die im Zentrum der Leberpforte eventuell mündenden Gallengänge freigelegt und mit derselben Anastomose drainiert werden).
Aus diesen präparatorisch gefundenen Verläufen der intrahepatischen Gallengängchen zog Schweizer den Schluss, dass man den Gallenabfluss verbessern könnte, wenn man beide Gruppen in einer Anastomose zwischen den Pfortaderästen fassen könnte. Die operative Präperation muss also beide Gallengangsgruppen fassen, was nur gelingt, wenn man die Gefäßchen von den Pfortaderästen befreit und nach medial in der Mitte der Leberpforte führt. Diese Präperation ist jedoch sehr riskant(=risky, wie Morio Kasai in einem Gespräch später sagte), und gelingt nur mikrochirurgisch, ist nicht jedem Chirurgen zu-zu-muten.
=>Nach den genannten mikroskopischen Studien operierte mein Vater innerhalb von 4 Jahren 9 Kinder mit einer Gallengangsatresie, sowohl in der eigenen Klinik als auch konsiliarisch in auswärtigen Kliniken.
Methode:
Er löste die Gallengängchen mikroskopisch von den Wänden der beiden Pfortaderäste, wobei die Leberpforte nicht nur in der Mitte, sondern breit (=vom rechten bis linken Pfortaderast), um die portal verlaufenden Gallengänchen in einer Anastomose mit einem Neogallengang aus dem Dünndarm fassen zu können.
Dieses präparatorische Verfahren, das mein Vater damals an 10 neugeborenen Schweinchen und danach an 6 Kindern mit Extrahepatischen Gallengangsatresie angewandt hatte, waren dann auch Grundlage für eine Habilitationsschrift, die in deutsch- und englischsprachigen Journalen veröffentlicht wurde.
Die Journale mit der Habilitationsschrift wurde damals auch vom seinerzeit an der Züricher Klinik arbeitenden Direktor Prof. Rickhäm gelesen. Er teilte Prof. Dr. Andreas Flach mit, dass ein japanischer Kinderchirurg mit einer sogenannten Hepatoporto-Jejunostomie Kinder mit Gallengangsatresie operiert habe. Er war in Japan auf Ferienreise und hatte (zufällig) einen Vortrag von Morio Kasai (geb. 1922 - gest. 2008) gehört, der mit diesem Vortrag sein Verfahren den Kollegen in Japan vorstellte.
Eine internationale Publikation von seiner Arbeit gab es damals aber noch nicht, sodass hier in der Bundesrepublik Deutschland und in den Nachbarstaaten nach einer Recherche, die Dr. Ilse Kerremanns durchführte, nichts von der Methode bekannt war.
Nachdem mein Vater das von ihm entwickelte Verfahren auf einem Kongress für Pädiater und Kinderchirurgen in Darmstadt vorgestellt hatte, tauchte die Frage auf, wer nun der Inaugurator der neuen Methode ist.
Prof. Dr. Waldschmitt aus Berlin fragte meinen Vater, ob er mit ihm zusammen in Berlin einen Kongress über die Methoden abhalten könnte. Waldschmitt organisierte den Kongress und mein Vater lud Morio Kasai aus Japan zu dem Kongress ein.
Als unser Vater auf diesem Kongress seine Ergebnisse aus präparatorischen Studien vorgestellt hatte, sagte Morio Kasai den für die Ohren unseres Vaters entlastenden Satz, den er sofort aufschrieb: Your procedure is not a Kasai procedure, call it Schweizer procedure or a modification of Hepatoporto-Jejunostomie. Und am Abend des Kongresses saßen die Beiden im Hotel zusammen und einigten sich auf den Terminus: The Schweizer procedure is a very, very „risky“ method, but call it an Extendit Hepatoporto-Jejunostomie.
Unter den Pädiatern spricht man jedoch nach wie vor von der Kasai-Operation, denn ein Kinderarzt aus einer deutschen Klinik, der sich früh für Lebertransplatationen bei Kinder mit Gallengangsatresien ausgesprochen hatte, brachte die Kunde aus Zürich mit, wo er an einer Tagung teilgenommen hatte. Er brachte das Kasai-Verfahren dann mit Vorträgen unter die Kinderärzte. Am Kongress in Berlin hatten jedoch nur sehr wenig Kinderärzte teilgenommen, weil sie, wie Dr. Edith Haase sagte, für die seltene Krankheit kaum Interesse aufbrachten. Sie haben daher bis heute nicht verstanden, was der Unterschied der beiden Methoden ausmacht (sagte eine Chriurgin aus der Schweiz), als ihr mein Vater bei einer Hepatoporto-Jejunostomie assistierte.
(Trotz des Kongresses in Berlin, der von Prof. Dr. Waldschmidt moderiert wurde, wird das Verfahren nach wie vor Kasai-procedure genannt. Sogar Mütter von operierten Kindern sprechen vom Kasai-Verfahren. In einem Gespräch, das ich mit einer Mutter nach einer Abschlussuntersuchung ihres damals schon 32-jährigen Sohnes führen durfte, nannte Sie mein Verfahren auch Kasai-Operation. In einem Brief, den ich mehreren Kinderärzten verschickt habe, beschrieb ich zwar den Unterschied zwischen dem Kasai-Verfahren und das von mir entwickelte Verfahren (siehe Abb. 7). Professor Rothauwe aus Bonn schrieb mir, dass mein Vorgehen inzwischen von allen Müttern, die er kennt, Kasai-Operation genannte wird. Dieser Name habe sich (einfach) eingebürgert. Dagegen habe ich, da ich damals schon emeritiert war, keinen Einwand erhoben.
(Abb. 7a und 7b): Der Unterschied zwischen dem von Morio Kasai inaugurierten Verfahren und dem von Schweizer entwickelte Verfahren liegt in der Breite der Eröffnung der Leberpforte. Kasai beschränkt sich (wie er mir selbst sagte) auf das Zentrum der Leberpforte, das Verfahren nach Schweizer öffnet die Leberpforte jedoch in ganzer Breite, vom linken bis zum rechten Pfortader-Ast, wo er in seinen histologischen Untersuchungen mehr Gallengängsrudimente nachweisen konnte. Mit dieser breiten Eröffnung der Leberpforte konnte er mehr Gallengängchen öffnen, was auch in der Dissertation von Michael Schweizer zum Ausdruck kommt. Als ich mit Kasai diesen Unterschied besprach, kommentierte er den Unterschied mit dem englischen Wort „risky, very risky“, was ihn abhielt die Leberpforte bis zu den beiden Pfortaderästen frei zu präparieren.)
Historischer Rückblick auf die Forschung
Als Paul Schweizer 1970 als Assistent in die Klinik für Kinderchirurgie der Universität Tübingen eintrat war die Kinderchirurgie in West-Deutschland noch ein Stiefkind. Es gab damals nur einige kleinere kinderchirurgische Einheiten an großen städtischen Krankenhäusern wie beispielweise am Kinderkrankenhaus Stuttgart, Hannover, Bonn und Bremen. Die Universität Tübingen gründete erst im Mai/ 1971 eine selbständige Abteilung für Kinderchirurgie. Andere europäische Länder wie beispielweise die Schweiz, England, Norwegen hatten dagegen schon früher kinderchirurgische Abteilungen gegründet. West-Deutschland war quasi Entwicklungsland. Charakteristisch war seinerzeit auch, dass es kein deutschsprachiges Lehrbuch und kein Journal für Kinderchirurgie gab, sodass deutsche Ärzte, die Kinderchirurgie als ihr Fach ausgewählt hatten, ihr Wissen vorwiegend aus speziellen englischsprachigen Büchern und Journalen erwerben mussten.
Trotz dieser initalien Rückständigkeit arbeiteten sich die Assistenten rasch in die kinderchirurgisch relevanten Krankheitsbilder ein. Trotz dieses initialen Mangels wurden nach ca. 4 Jahren die ersten wissenschaftlichen Arbeiten aus den Federn von Tübingern kinderchirurgischen Ärzten in nahmhaften Journalen pupliziert und erste Posterpreise gewonnen. Paul Schweizer nannte z.B. Arbeiten über die Entstehung und Therapie angeborener Fehlbildungen der Nieren und Harnwege,der Speiseröhre, der Gallenwege, besonders der Gallengangscysten und der Extrahepatischen Gallengangsatresie, die Fehlbildung des Enddarms wie z.B. die Rektrumatresien, neue Techniken zur Versorgung komplizierter Knochenbrüche der Beine, des Armes, des Becken, des Bruskorbs unter Schonung der noch wachstumsfähigen Wachstumsfugen. Mit diesen nur pars pro toto"ein Teil für das Ganze" erwähnten Krankheiten ist das Thema wenigstens randständig beschrieben.
Kurzum: Die Kinderchirurgie in Tübingen erarbeitete rasch den Anschluss an internationale Standards. Tübingen hatte sogar einen Vorteil, denn die meisten Assistenten der damaligen Zeit hatten bereits Erfahrung, oder sogar eine Facharztausbildung in Allgemeinchirurgie durchlaufen, sie kannten grundlegende operative Techniken. Zu diesen Assistenten gehörte in vorderster Reihe auch Paul Schweizer, Peter Reifferscheid und Dieter Schaupp.
Nach diesen kurzen Hinweisen zur Enstehung der Tübinger Klinik für Kinderchirurgie fragten wir Paul Schweizer nach besonderen Operationen in seiner Zeit als Kinderchirurg.
Paul Schweizer legte Wert auf den Hinweis, dass Kinderchirurgie trotz der Zugehörigkeit zum Fach Chirurgie, auch breites Wissen von Kinderkrankheiten haben muss, besonders auch die Entwicklung von Fehlbildungen in der fetalen und embryonalen Phase beachten müssen. Kinderchirurgen müssen daher über die Allgemeinchirurgie hinaus noch anderes Wissen hinzulernen. Wie breit Kinderchirurgie angelegt werden muss, kommt nach Schweizers Meinung in einer Beschreibung von Beispielen aus seiner Praxis zum Vorschein. Die folgenden 8 Beispiele sollen nun erwähnt werden, die oft zu Maßnahmen führten, die intraoperativ nur wissenschaftlich gelöst werden konnten, weil sie in Journalen und Fachbüchern noch nicht, oder nur ungenügend erwähnt wurden.
Insofern sind Operationen in der Kinderchirurgie auch Gegenstand eines neuen, wissenschaftlich begründeten Zuwachses, was Kinderchirurgische Forschung oft in ein anderes Licht bringt, als allgemein unter Wissenschaft verstanden wird.
An neun Beispielen soll gezeigt werden, wie chirurgisch relevante Krankheiten intraoperativ wissenschaftliches Denken fordern. Operationen setzen zunächst umfangreiches Wissen über die Anatomie/Histologie von Organen und Geweben voraus. Zudem muss die Funktion der Organe einschließlich der Gewebe bis zu den Katalysen in Zellen bekannt sein. Darüber hinaus muss der Operateur den Wärme- und Blutverlust seines Patienten in jeder Phase der Operation beachten und messen. Er muss über Vorerkrankungen, besonders Allergien und andere Unverträglichkeiten seines Patienten informiert sein, sogar individuelle Reaktionen auf Medikamente verstehen und ins Kalkül einer Operation einbringen. Er muss intraoperativ rationale, logische Entscheidungen treffen, wenn in der Anatomie oder nach einer intraoperativ durchgeführten histologischen Gewebsuntersuchung z. B. Variationen erkennbar werden. Er muss auch über die Ausdehnung und die Zumutung einer ausgedehnten Präparation rationale Überlegungen anstellen. Insofern muss der Operateur während der Operation ständig wissenschaftlich denken und handeln können.
Diese Anforderungen sind in unterschiedlichem Maß Gegenstand jeder Operation. Sie setzen in der Kinderchirurgie zwingend embryologisches Wissen und Verständnis voraus.
Zusätzlich zu den Aussagen über die Forschung und Praxis des Krankheitsbildes Extrahepatische Gallengangsatresie (siehe oben) werden nun noch 8 Beispiele beschrieben, die exemplarisch zeigen sollen, was von Kinderchirurgen an Wissen und Fähigkeiten gefordert wird.
Zweites Beispiel
Das Wissen über die Embryologie und der Anatomie einer Krankheit
Fehlbildungen im und am Körper eines Menschen können nur erkannt und verstanden werden, wenn ihre fetalen und embryonalen Organentwicklungen bekannt sind. Jeder Kinderchirurg muss daher mit der fetalen und embryonalen Entwicklung der Organ- und Gewebesysteme vertraut sein,
so lautete Schweizers Credo für einen Unterricht in Kinderchirurgie.
Paul Schweizer wollte nach seiner Facharztausbildung in Chirurgie zwar Lungen-, oder Unfallchirurg werden. Da sich der damalige Oberarzt der Klinik für Kinderchirurgie jedoch eine Handverletzung zuzog, die ihm über eine lange Zeit das Operieren nicht erlaubte und der Chef der Kinderchirurgie selbst krank war, wurde akut ein Nachfolger ins Amt des Oberarztes gesucht. Von einer Minute auf die andere Minute musste Schweizer, der damals in der Unfallchirurgie arbeitete, die kommissarische Leitung der Kinderchirurie übernehmen.
Nach dieser, ihm nicht leicht gefallenen Entscheidung, die aber von der Universitätsverwaltung gefordert wurde, studierte er wochenlang Schriften über Embryologie, wozu auch das Buch "The acute adbomen in Infancy and childhood" von seinem amerikanischen Freund John G. Raffensberger et al.gehört. Dieses Buch übersetzte Schweizer später auch auf Wunsch von Raffensberger ins Deutsche. Diese Übersetzung erschien als Buch 1974 im Schattauer Verlag Stuttgart, New York.
Andere Schriften, die er damals las, um für Kinderchirurgie mit ihren Fehlbildungen präpariert zu sein, waren auf einem Zettel zu finden, der in einem seiner Tagebücher Platz gefunden hatte. Es waren die Schriften: D.H. Padget (1948) Embryologie./ H. Spemann (1938) Embryologie./ D. Starck (1975) Embryologie./ L.B. Ary (1965) Developmental Anatomy./ J .D. Boyd (1971) The human placenta./ E. Blechschmidt (1963) Der menschliche Embryo. / W. J. Hamilton (1972) Embryologie , Prenatal Development. / (Ich vermute, dass es sich dabei nur um eine Auswahl handelt, denn damals stapelten sich in unserem Wohnzimmer viele Wochen hindurch eine Menge Bücher der Embryologie und Anatomie, sodass die Nennung der Schriften nur Ausdruck einer Auswahl sein kann).
Nach dem Studium dieser Bücher der Embryologie und der Fehlbildungen ergänzte unser Vater sein bereits als Student begonnenes Heft über Embryologie und verfasste damit ein neues Manuskript mit vielen Abbildungen (Abb. 8). In dieses neue Manuskript fügte er laufend Berichte über die Anatomie von Fehlbildungen ein, die er als Operateur erfahren hat. Dieses Manuskript übergab er bei seiner Emeritierung 2002 mit dem Universitätsstempel versehen der Bücherei der Chirurgischen Klinik. Es trug den Titel: Manuskript über Embryologie und Fehlbildungen, für Studierende der Medizin in Tübingen. (Mit Bedauern musste jedoch schon 2019 festgestellt werden, dass dieses Manuskript nicht mehr im Bücherregal der Chirurgie steht. Trotz Recherchen durch die Klinikverwaltung ist es nicht mehr auffindbar.) Ein paar Skizzen, die er damals für eine Vorlesung anfertigte, demonstriert die (Abb. 8). Es sind Zeichnungen, die er für ein Seminar anfertigte und zu einem Manuskript verarbeitete.
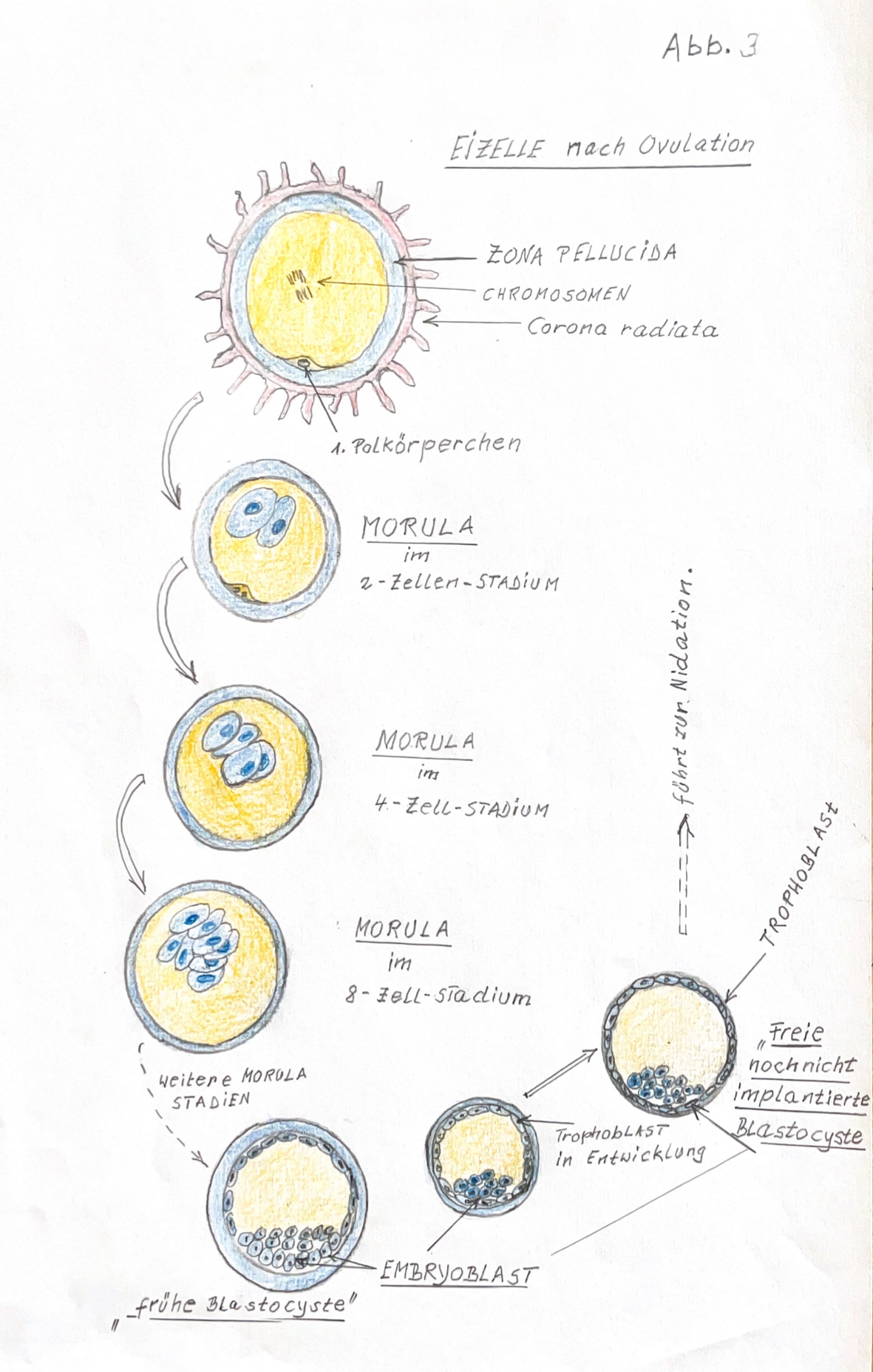
Deshalb können nur noch wenige Zeichnungen erwähnt werden, die in seinem Manuskript vorhanden waren: (Abb. 8-1) Eizellen nach Ovulation (ursprünglich Abb. 3 im Manuskript), (Abb. 8-2) Embryoblast am 7. Tag nach Ovulation (ursprünglich Abb. 2 im Manuskript), (Abb. 8-3) Vorbereitung der Nidation (ursprünglich Abb. 4 des Manuskripts), (Abb. 8-3) Die drei Keimblätter (ursprünglich Abb. 4 des Manuskripts), (Abb. 8-4) Blastocyste (ursprünglich Abb. 6a und 6b des Manuskripts), (Abb. 8-4) Zona pellucida (ursprünglich Abb. 6c im Manuskript), (Abb. 8-5) Trophoblast, Plazenta (ursprünglich Abb. 6c im Manuskript), (Abb. 9) Bild neu: Herzentwicklung, (Abb. 6c) im verschollenen Manuskript.
 (Abb. 8-1),
(Abb. 8-1), 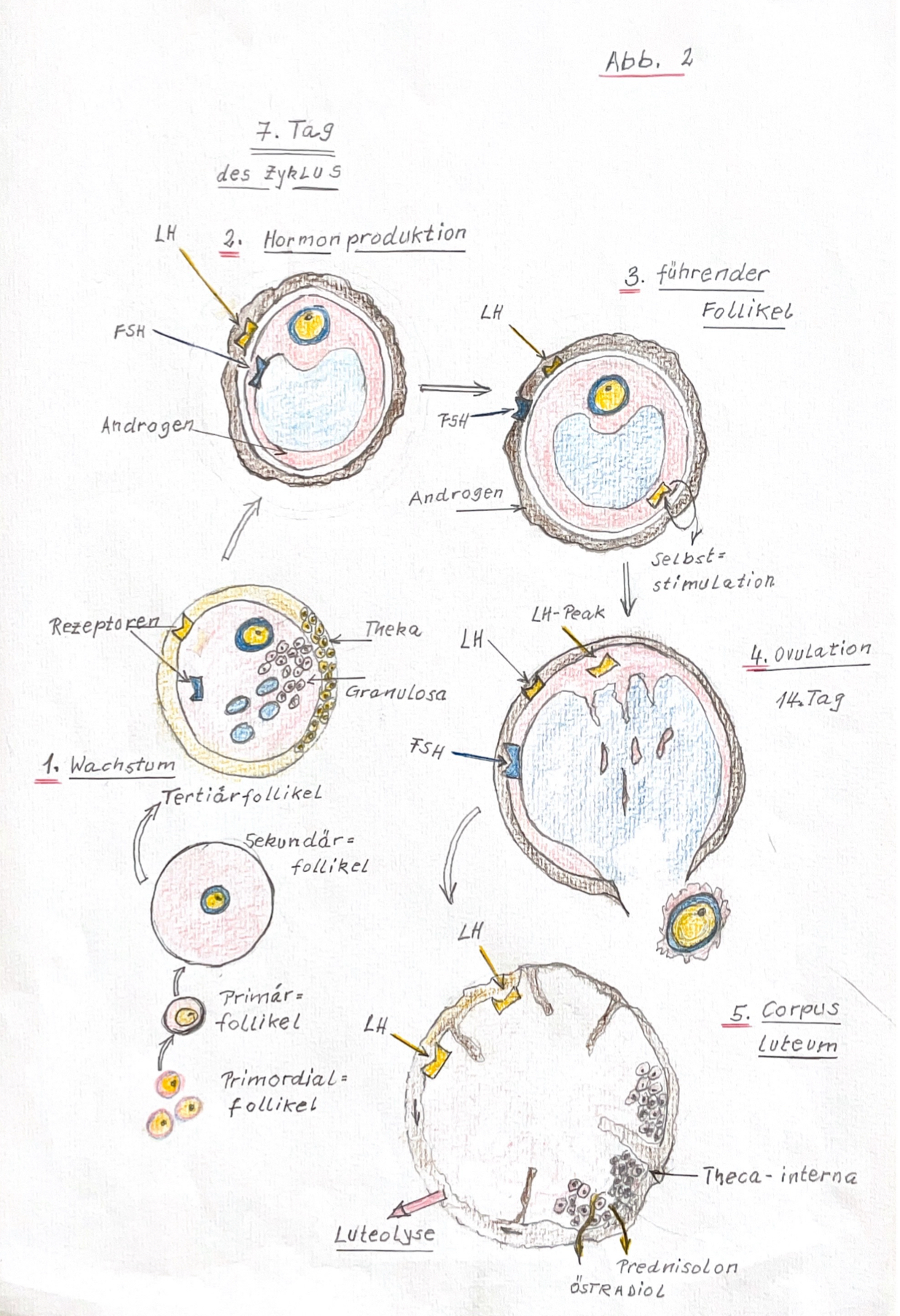 (Abb. 8-2),
(Abb. 8-2), 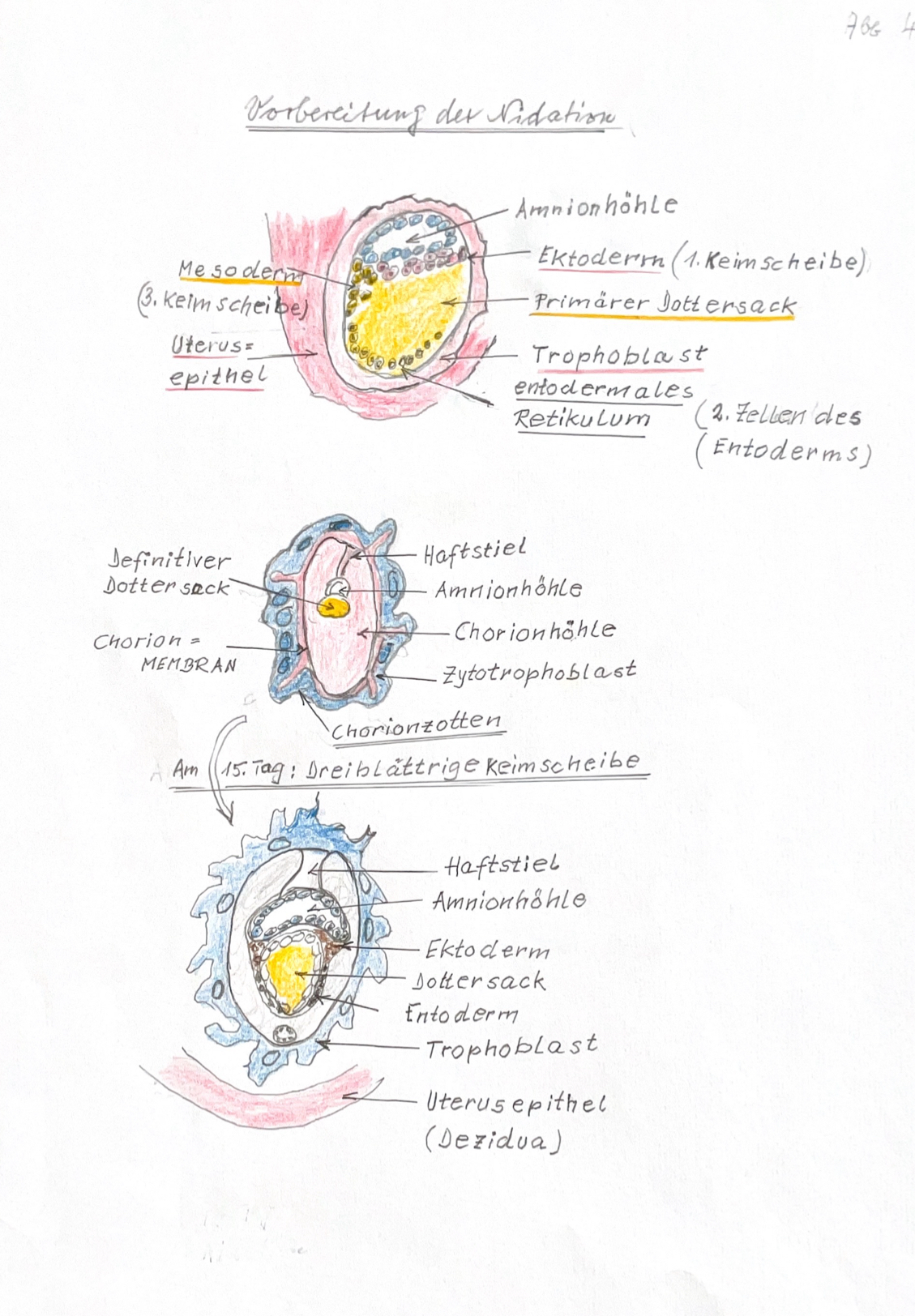 (Abb. 8-3),
(Abb. 8-3), 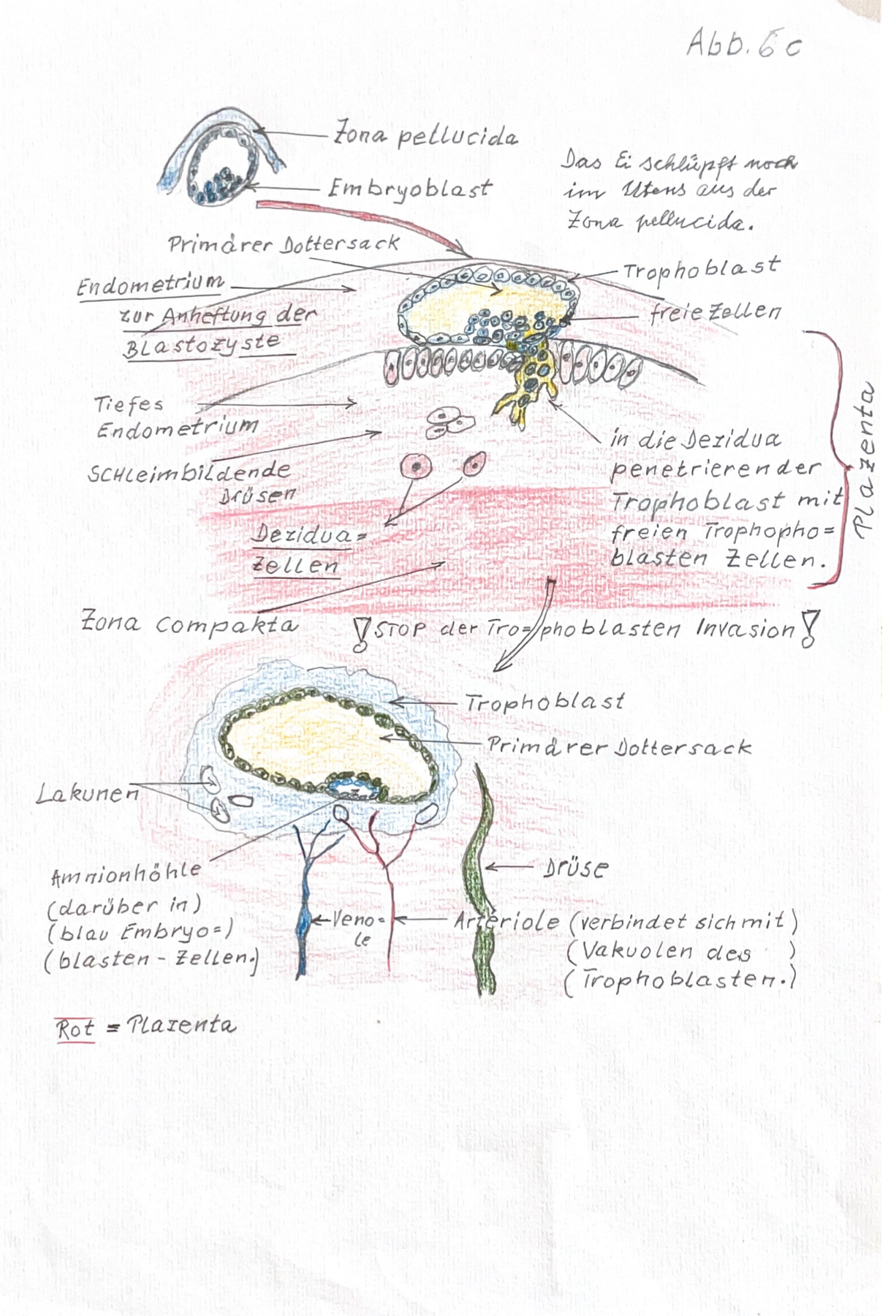 (Abb. 8-4),
(Abb. 8-4), 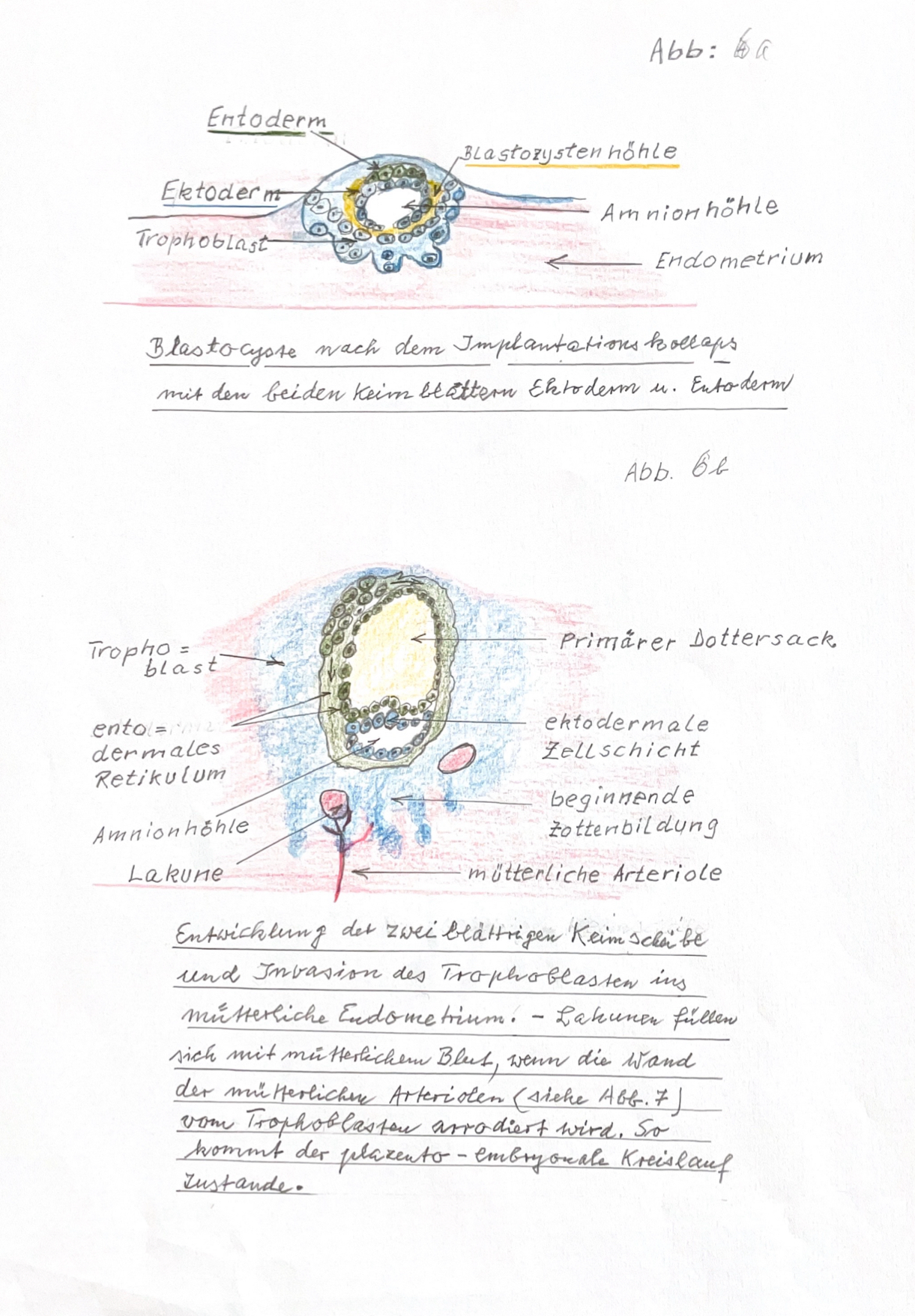 (Abb. 8-5),
(Abb. 8-5), (Abb.8-1 - 8-5): Schematische Darstellung zur "frühen Embryologie des Menschen"
1. Menschliches Leben beginnt mit der Vereinigung einer reifen Eizelle mit dem Spermium. Das reife Ei nennt man Follikel.
2. Voraussetzung für die Embryogenese eine Eizelle ist, dass das reife Ei den Eierstock verlassen hat. Man nnnt diesen Vorgang Eisprung = Follikelsprung =Ovulation.
3. Der Follikel wandert nun aktiv durch den Eileiter = Tuba uterina in die Gebärmutter = der Uterus.
4. Der Eisprung = Ovulation findet in der Mitte des Menstruationszyklus statt.
5. Ein Ei ist reif = geschlechtsreif = für die Fortplanzung geeignet, wenn es hormonell stimuliert wurde. Follikelstimulierende Hormone sind: FSH = Follikelstimulierende Hormone und LH =Luteinisierendes Hormon.
6. In der hormonellen vorbereiteten Schleimhaut des Utreus findet dann Befruchtung des Follikels statt. Die Befruchtung = Fertilisation ist die Verschmelzung einer reifen Eizelle mit einem Spermium. Eizelle und Spermium werden jetzt Gameten genannt.
7. Durch die Befruchtung entsteht eine neue, individuelle Zelle mit neuer Genkombination. Diese neue Zelle wird nun Zygote genannt..
8. Nun fängt die Zygote an zu wachsen und sich in neue Zellen zu teilen. Es entsteht nun die Morula, = die 2 Zellen aufweist, die 4 Zellen Morula, ein 8 Zellstadium und danach die sog. frühe Blastozyste.
9. In der Blastocyste entsteht durch Wachstum und Zellteilung der sog. Embryoblast mit den ersten spezialisierten Zellen, die den Trophoblasten entwickeln. Der Trophoblast ist eine Zellschicht welche die Nidation = die Anheftung der Blastozyten in der mütterlichen Uterusschleimhaut bewältigen muss.
10. Am 15. Tag nach der Befruchtung entsteht in einem Holraum der Blastzyste eine Zelldifferenzierung in drei sog. Keimblätter: das Ektoderm, dass Mesoderm und das Entoderm statt.
11. Zugleich sorgt der Trophoblast dafür, das die mütterliche Uterusschleimhaut zu einer Dezidua = zur späteren Plazenta umgewandelt wird.
12. Das nun Embryoblast genannte Zellkonstrukt entwickelt sich danach durch Zellvermehrung und Zelldifferenzierung zum Embryo.
(Die Herzentwicklung (Abb. 9): Das Herz entsteht aus einem Herzblastem (=einer Ansammlung von primären Zellen), die wahrscheinlich aus dem Mesoderm stammen. Dieses Mesoderm liegt als Blatt vor der Kopffalte des Embryos. In diesem Blatt bildet sich in einem 1. Schritt ein Spalt, der sich zur Perikardhöhle weiterentwickelt.) In einem 2. Schritt entwickelt sich dann am Boden der Perikardhöhle eine kardiogene Platte von Zellen, welche die Anlage zum Myokard ist.
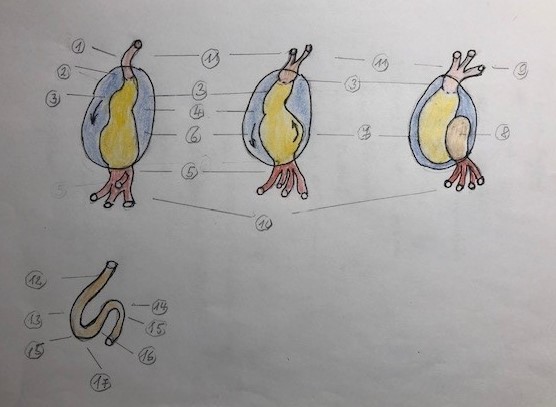 (Abb. 9)
(Abb. 9)
1. Aortenbogen
2. Truncus
3. Bulbus cordis
4. Venticulus communis
5. Sinus venosus
6. Herzbeutel/ Pericard
7. linker Ventrikel
8. linker Vorhof
9. Truncus arteriosus
10. Einströmbahn
11. Abflussbahn
12. Ebene der Aorta und Pulmonaliskappe
13. Herzschleife nach rechts
14. Vorhofebene
15. Atrio-Ventrikelebene
16. Herzschleife nach rechts
17. Herzspitze
Zwischen der mesodermalen Myocardplatte und einer aus entodermalen Zellen des ursprünglich mesodermalen Myokards entstandenen Zellhaufens entwickeln sich Gefäße für das Myocard.
Diese primäre Herzanlage am Boden der Perikardhöhle verlagert sich nun in einem 3. Schritt als Folge der Aufrichtung (=Streckung der Kopffalte) und dreht sich gleichzeitig um ca. 180 Grad. Dadurch verlagert sich die Herzanlage unter und dorsal des Vorderdarms.
Gleichzeitig proliferiert das Endoderm und umschließt das mesodermale Myocard.
Nach Abschluss dieses 3. Schrittes bildet sich das Endoderm zu einem Endoderm-Schlauch aus, der vom Myocard ummantelt wird.
Dieser sog. Herzschlauch (der im Teil 3 der Abb. 9 dargestellt ist) entwickelt sich in der Pericardhöhle zur sog. Herzschleife (=Teil 4 der Abb.9) weiter.
In einem 4. Schritt dreht sich der leicht S-förmige Herzschlauch nach rechts, wahrscheinlich in Folge eines Wachstums in der Pericardhöhle. Die Einflußbahn verlagert sich dabei nach dorsal und nähert sich der proximal liegenden Ausflussbahn.
Von vorne betrachtet wird jetzt der Bulbus cordis besser erkennbar. Zugleich wölbt sich die Herzschleife nach ventral vor.
Für meine Studentinnen und Studenten waren die Bilder zur Embryologie des Herzens (wie eine Studentin sagte) nicht wichtig, jedoch wollten sie wissen, welcher Teil des embryologischen Herzens zu welcher Struktur des fertigen Herzens wird. An der Abb. 9 demonstrierte ich, was in der embryologischen Entwicklung zu welchem Teil des Herzens wurde: (1.) Der Truncus arteriosus wird zur Aorta und zur Arteria pulmonalis. (2.) Der aufsteigenden Teil des rechten Schenkels wird zum rechten Ventrikel. (3.) Der sog. Vorhof wird zum rechten und linken Vorhof. (4.) Der Sinus venosus wird zum Sinus cordis. (5.) Der sog. absteigende Teil wird zum linken Ventrikel.
(Die Entwicklung der Herzseptierung, der Herzklappen und die Umgestaltung der Herzschleife zum definitiven Herzen durch Wachstum, Drehung, Faltung soll hier nicht beschrieben werden. Schweizer verweist auf das Buch Norbert Ulfig/Beate Brand-Saberi: Kurzlehrbuch Embryologie (2009).
Um eine Vorstellung vom ursprünglichen Manuskript zu bekommen, werden die 5 Seiten des verschollenen Manuskripts in einer gemeinsamen (Abb. 8) erwähnt. (Die Qualität der (Abb. 9) kann kritisiert werden, es muss aber berücksichtigt werden, dass sie schon von mehreren Doktoranden/ Doktorandinnen und Prüflingen benutzt wurden).
Als er nach seiner Habilitation zum Professor für Allgemeinchirurgie/ Unfallchirurgie und Kinderchirurgie ernannt worden war, (ein Unikat in der Baden-Württemberger Hochschulverwaltung), übernahm er als Teil der Chirurgie den akademischen Unterricht in diesem Fachgebiet und musste den Studierenden auch die oft schwierigen Entwicklungen der Organe und deren Fehlbildungen verständlich machen.
Im Sommersemester 1975 begann er mit einer viel besuchten embryologisch orientierten Donnerstag-Abend-Visite in der Kinderchirurgie. Als er seinen Studenten:innen Hausaufgaben abverlangte klagten sie bald, dass sie keine Literatur zur Embryologie finden. Ich kopierte ihnen deshalb mein Manuskript, das ich mir in den Jahren davor, teils als Student, teils als Arzt erarbeitet hatte. Dieses Manuskript durften sie für Ihre Ausarbeitungen ihrer Referate benutzen. Bald beklagten sich die Studenten:innen jedoch, dass mein Manuskript zu wenig klinische Daten und zu wenig Hinweise auf biochemische Vorgänge enthält. Also setzte sich unser Vater erneut hin und arbeitete zum besseren Verständnis der Embryologie in den Nächten und Wochenenden klinische und biochemische Daten in sein Manuskirpt ein.
Drittes Beispiel
Ein Splenorenaler (Not-)Shunt bei einem Kind an der Tübinger Kinderchirurgie
An einem Freitagabend wurde ein 12-jähriges Mädchen mit starkem Bluterbrechen in die Klinik eingeliefert. Unser Vater wollte gegen 20.45 Uhr die Klinik verlassen und kam im selben Augenblick an der Poliklinik vorbei, als Sanitäter das 12-jährige Mädchen von ihrer Trage auf einen Untersuchungstisch in unserem Ambulanzraum umlagerten. Im selben Augenblick erbrach sie eine Fontäne Blut. Unser Vater, der eigentlich nach Hause gehen wollte und von uns Kindern schon erwartet wurde, war sofort überzeugt, dass das Mädchen eine Ösophagusvarizenblutung hat. Er zog seine Jacke aus, krempelte die Hemdsärmel hoch, (ließ privates Leben privates Leben sein) und suchte an beiden Armen nach geeigneten Venen. Danach hatte er ein bis auf die nackte Haut blutverschmiertes Hemd und eine blutverschmierte Hose, weil das Mädchen pausenlos Blut erbrach. Zudem wies er den Pfleger an sofort 6 Liter Blut der Blutgruppe 0 aus der Blutbank zu holen.
(Zu diesem Geschehen gibt es eine Anekdote, die uns eine Schwester erzählte): Bevor Schweizer den OP betrat und die Lagerung der Patientin auf dem OP-Tisch durchgeführt wurde, duschte er sich kurz das Blut vom Leib und zog danach OP-Kleidung an. Dann betrat er den OP-Saal. Seine blutverschmierte Kleidung lag im Umkleideraum auf einer Bank. Als Schweizer am Operieren war, wurde ein Pfleger von einer Schwester stillschweigend in den Vorraum geschickt, um die Kleidung in einen Waschraum zu bringen. Nach der Operation duschte er nochmals und wollte sich seine Kleider wieder anziehen, aber sie waren nicht mehr auffindbar. Schweizer soll sehr irritiert nach seiner Kleidung gesucht haben, zog sich schließlich frische OP-Kleidung an und verlies mit ihr später die Klinik, um mitten in der dunklen Nacht seine 4 km nach Hause zu gehen. Die Op-Schwestern und der Pfleger hatten ihren Spaß, entschlossen sich aber, ihm hinterher zu fahren. Auf halber Strecke erreichte ihn der Pfleger und fuhr ihn nach Hause).
Als die Infusionen liefen und das Mädchen intubiert war, fuhren ein Pfleger, unser blutverschmierter Vater und ein Assistent mit dem Kind in den OP, wo bereits OP-Schwestern den OP-Tisch und das Instrumentarium herrichteten. Zur gleichen Zeit kam die Diensthabende Ärztin mit einer Senkstakensonde an, die aber nicht angewandt wurde, weil unser Vater (wie er ihr sagte) keine guten Erfahrungen mit diesem Versuch, Ösophagusvarizenblutungen zu stillen, gemacht hatte.
In der Zwischenzeit hatte ein zweiter Pfleger bereits stillschweigend den Betreuer der Endoskopie-Abteilung angerufen, der von zuhause kommen musste, um uns passende Endoskope zu bringen. Er kam mit drei Endoskopen in den OP und bot unserem Vater spontan das passende Endoskop an. Ein nasal eingeführter Schlauch zum Absaugen des Blutes aus dem Ösophagus war ihm bei dieser Endoskopie keine Hilfe. Er brach die Endoskopie deshalb ab, zumal er gesehen hatte, dass das Blut nicht aus dem Magen, sondern aus einem Varizenknäuel im unteren Ösophagus kommt.
Nachdem das Mädchen exakt intubiert war, die beiden Infusionen am Arm und eine dritte am Hals gut funktionierten und die erste Konserve mit der Blutgruppe 0 angelegt war, begann die Operation.
(Anstelle mit seinen Kindern gemeinsam das Abendbrot zu essen), führte er am OP-Tisch einen Schnitt von der Brustbeinspitze bis knapp unterhalb des Nabels aus. Während er diese Prozedur durchführte fragten die OP-Schwester und der Anästhesist, was er denn für eine Operation beabsichtige. Einen Splenorenalen Shunt, sagte er kurz und bündig. Dem Anästhesisten empfahl er zudem, ständig Blut zu transfundieren. Der Anästhesist sagte nur: "Blutdruck systolisch 54, aber steigend".
Rasch legte unser Vater nun die Milz, die Milzvene und die linke Nierenvene frei, maß die Abstände der beiden Venen, trennte die Milzvene hinter dem Pankreaskopf durch und anastomierte sie mit der linken Nierenvene End-zu-Seit.
Seit der Einlieferung des Kindes und der Fertigstellung der Anastomose zwischen Milz und linker Nierenvene waren fast zwei Stunden vergangen, wobei der Blutdruck von initial 42 mm HG auf 79 mm HG angestiegen war. Die Präparation der Milz- und der Nierenvene schaffte er in dieser relativ kurzen Zeit nur, weil das Mädchen sehr schlank und die Milzvene gut sichtbar am unteren Rand des Pankreas verlief.)
Nach einem kurzen Gespräch mit dem Anästhesisten über das weitere Vorgehen kontrollierte er seine Anastomosen an den beiden Venen auf Dichtigkeit. Mit 3 zusätzlichen Nähten an der Anastomosenhinter- und -vorderwand konnte Bluttrockenheit geschaffen werden und der Blutfluss durch die Anastomose war tastbar.
Nun machte das Operationsteam ca. 7 Minuten Operationspause, damit der Anästhesist den Blutdruck noch weiter stabilisieren konnte. In dieser Zeit saugte er als Operateur nun das Blut aus dem Magen und dem Ösophagus. Nach der Plazierung einer nasal eingeführten Magensonde wurden die Eingeweide der Bauchhöhle wieder anatomiegerecht gelagert und die Bauchhöle schichtweise verschlossen.
Fazit: Der Splenorenale Anastomose ist eine künstliche Veränderung des Blutkreislaufes, denn jetzt fließt das Blut aus der Milz, teilweise auch des Magens und des Pankreas, sowie des gesamten Darmkonvoluts nicht mehr durch die Pfortader und damit durch die Leber, sondern durch den sogenannten Splenorenalen Shunt über die Nierenvene an der Leber vorbei ins Herz.
Es ist also ein Umgehungskreislauf geschaffen worden.
Das Mädchen wurde dann beatmet, mit den angelegten Infusionen und einem Blasenkatheter auf die Intensivstation verlegt, als der systolische Blutdruck über eine halbe Stunde konstant über 95 mm Hg blieb. Entscheidend für die postoperative Kontrolle, wertete unser Vater (so berichtete er uns) auch die Menge des Urins pro Zeiteinheit, den Abbau von Ammoniak, den eine gesunde Leber abbauen muss und selbstverständlich auch den HB-Gehalt wegen des starken Blutverlustes.
Pascalina erholte sich zügig, nach 12 Stunden konnte sie extubiert werden. Schon am zweiten Tag durfte sie, gestützt durch eine Schwester, auch auf der Station umhergehen. Unser Vater verriet ihr bei der Visite nach zwei Tagen, dass sie das erste Kind ist, bei dem in Tübingen ein Splenorenaler Shunt angelegt worden ist. Ihre Reaktion: "Dann war ich ihr Versuchskaninchen". Diesen verstecketen Vorwurf konnte er jedoch abwehren, denn er hatte davor schon bei erwachsenen Patienten Shunt Systeme assistiert und unter seinem Oberarzt, Prof. Geisbe, selbst durchgeführt.
Aber: An der Universitätsklinik Tübingen war Pascalina das erste Kind, das jemals eines Shunts bedurfte. Insofern war die Operation eine Premiere an der Kinderchirurgie in Tübingen.
Viertes Beispiel
Eine andere Premiere, (aber nochmal eine Ösophasgusvarizenblutung).
Ein 8-jähriges Mädchen wurde auch an einem späten Abend mit Bluterbrechen in die Klinik gebracht und Schweizer dachte sofort an eine Ösophagusvarizen-Blutung. Die Konstellation war jedoch anders, sodass eine andere therapeutische Entscheidung getroffen werden konnte. Da die Blutung nicht massiv war, entschloss sich Schweizer zunächst zu einer Endoskopie in der Hoffnung, die Blutstillung durch eine Verödung der Ösophagusvarizen zu erreichen.
Während er mit seinen Ärzten und Schwestern beschäftigt war, den Kreislauf des Mädchens zu stabilisieren, mehrere Liter Blut zu bestellen und ein Endoskop in die Speiseröhre einzuführen, stürmte eine ältere, auffallend kleine, rabiate Frau ins Untersuchungszimmer und ließ sich selbst von einem imponierend starken Pfleger nicht abweisen. Sie stellte ihren Fuß in den Türspalt und alle Anwesenden hörten sie heißer schreien: Das Mädchen ist doch meine Enkelin. Da die Blutung aus dem Ösophagus nicht überwältigend bedrohlich und die Übersicht im Ösophagus daher überschaubar war, sah Schweizer rasch, dass das Blut aus dem unteren Ösophagus kommt. Er konnte das blutende Gefäß endoskopisch veröden und die Endoskopie beenden.
Damit war aber unsere therapeutische Absicht noch nicht endgültig beendet, denn wir wussten nicht, ob die Maßnahme erfolgreich bleiben wird. Eine Nachblutung ist nicht selten. Wir entschlossen uns trotzdem keinen weiteren Eingriff durchzuführen, sondern den Verlauf zu beobachten.
Um die Intubation des Mädchens durch den Anästhesisten und die Suche nach Venen am Arm durch seinen Assistenten nicht zu stören, ging Schweizer zur Tür, wo der Pfleger noch mit der Frau beschäftigt war, die ihren Fuß nicht aus dem Türspalt nahm.
Er stellte sich vor, nannte seinen Namen, nahm ihren Arm, und ging mit ihr ins Vorzimmer des Operations-Saals. Es dauerte nur wenige Sekunden, dann wusste er, dass Isabella nach der Geburt zur Wiederbelebung einen Nabelvenenkatheter bekommen hatte, jetzt jedoch aus Ösophagusvarizen blutete. Isabella hatte nach der Nabelvenenkatheterisierung Varizen im Ösophagus entwickelt, die nun bluteten. Eine Pfortdaderthrombose und Varizen in der unteren Speiseröhre führen nicht selten zur Ösophgagusvarizen-Blutung, die oft lebensbedrohlich, manchmal zwar rezidivierend, jedoch erträglich bluten. Isabella hatte akut und unerwartet eine Blutung bekommen, die endoskopisch verödet und gestillt werden konnte.
(Nun hatte Schweizer ca. 4 Wochen vor diesem Ereignis ein Gespräch mit dem Chirurgen Prof. Paquet aus Bad Kissingen über therapeutische Verfahren bei Erwachsenen mit Ösophagusvarizen-Blutungen geführt. In diesem Gespräch ging es auch um „perkutan-transhepatische-Zugänge“ in die Leber. Paquet berichtete von Versuchen amerikanischer Radiologen einen „transjugulären Zugang“ zu den Lebergefäßen einschließlich der Pfortader zu finden. In diesem Zusammenhang sprach er auch über Versuche an Hunden, die in Freiburg durch Radiologen durchgeführt werden, um Lebergefäße transjugulären zu untersuchen. Sie führten, soweit er informiert war, einen starren Katheter zwischen Pfortader und unterer Hohlvene ein.)
Mit diesen Mitteilungen ging Schweizer auf den Radiologen Schott zu, der ihm sagte, dass derartige Experimente auch schon an Menschen durchgeführt werden. Schott wusste schon, dass es einen sog. Palmaz-Stent gibt, der über ein Netzsystem eine Dehnung der Lebergefäße ermöglicht. Er äußerte sich hoffnungsvoll, dass dieses Verfahren eine Zukunft haben könnte. Nun studierten Schott und Schweizer unabhängig voneinander nochmals das Gefäßsystem der Leber und Schott besorgte die notwendigen Instrumente. Bald danach führte er nach der Beschaffung der notwendigen Geräte, besonders des Palmaz-Stents, den ersten transjugulären-intrahepatischen-portosystemischen-Stent-Shunt“ bei einem erwachsenen Mann mit einer Leberzirrhose durch. Dieser Shunt wird heute abgekürzt TIPPS genannt.
Es war selbstverständlich, dass Schweizer mit Schott auch über die Möglichkeit sprach, einen solchen Shunt bei Kindern durchzuführen. Schott zeigte sich wegen der anatomisch engeren und wandschwächeren Gefäße jedoch sehr skeptisch. Zudem gab es noch keine Erfahrungen in der Anwendung dieses Verfahrens bei Kindern und schon gar keine schriftlichen Berichte.
In Anwesenheit von Isabella sprach Schweizer mit Isabellas Großmutter über die Notwendigkeit einer Operation, um weitere Blutungen zu vermeiden. Er erwähnte die Anlage eines Spleno-renalen-Shunts, der eine Baucheröffnung forderte, und den TIPSS, der aber noch im frühen experimentellen Stadium war, jedoch keine Bauchöffnung forderte.
Jetzt kam Schweizer in große Schwierigkeiten. Die neunjährige Isabella hatte aufmerksam zugehört, jedoch nur den Hinweis aufgegriffen, dass beim TIPSS keine Baucheröffnung notwendig ist. Auf meine Einwände, dass ein solches Verfahren bei Kindern noch nie und selbst bei erwachsenen Patienten nur sehr selten durchgeführt wurde, ging sie im Gespräch gar nicht ein und legte auch auf die wiederholten Hinweise auf gravierende Nebenwirkungen keinen Wert. Wichtig war ihr nur, dass der Bauch nicht geöffnet werden muss. Sie blendete alle Risiken aus und war in einem einstündigen Gespräch nicht zu überzeugen, dass der Spleno-renale Shunt für sie weniger Risiken bringen wird als ein TIPSS.
Bei dieser Hartnäckigkeit der jungen Patientin ließ Schweizer Isabella mit ihrer Großmutter und einer Assistentin eine halbe Stunde allein, damit sie ohne seine Anwesenheit eine Entscheidung treffen können. Danach besuchte ich die Beiden wieder und musste das Ergebnis akzeptieren, dass sich Beide ausschließlich für den TIPSS entschieden hatten. (Die Assistentin berichtete mir danach, dass die Großmutter keine Chance hatte, ihre Enkelin umzustimmen).
(Mit den Eltern der Enkelin konnte Schweizer gar nicht reden, weil sie angeblich nicht erreichbar sind und ihre Ehe zudem zerrüttet ist).
In dieser Situation besprachen Schweizer und der Radiologe Schott das Vorgehen nochmals mit der Großmutter. Sie entschieden sich für einen TIPSS, (weil sie gar keine andere Wahl hatten).
Studenten, die bei der Prozedur zuschauten (aber wenig sehen konnten) musste ich das Vorgehen nochmals erklären. Ich erklärte ihnen den Vorgang mit 4 Skizzen, die ich an die Tafel zeichnete.
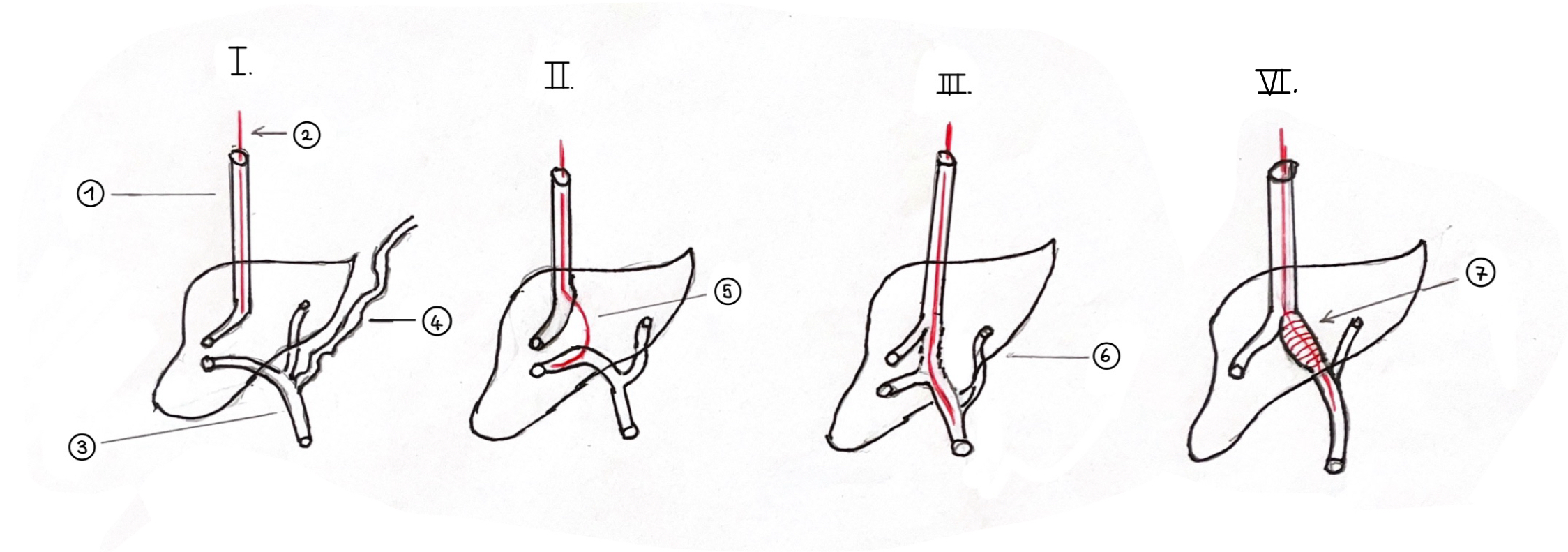
(Abb. 10)
(Abb.10): (Schematische Darstellung des TIPSS in 6 Schritten: 1. Punktion der Vena jugularis interna am rechten Hals und Einlegen des sog. Distanzkatheters. 2. Einführen eines transjugulären Katheters (in der Abb. rot) bis in die Leber. 3. Sonographisches Aufsuchen eines günstig zur Vena jugularis liegenden Pfortader-Astes und Anzeichnen des Verlaufs der Pfortader auf dem Bauch des Patienten. 4. Transparenchymatöse Punktion des Pfortader-Astes. 5. Stabilisieren des Punktionsweges mit einem steifen Führungsdraht. 6. Dilation des Parenchymtrakts und Einführen des sog. Palmaz-Stents über den Führungsdraht.)
Beschreibung der Technik des TIPSS
1. Schritt: Lokalisation der Pfortader mit einer Ultraschall-Untersuchung.
2. Schritt: Makierung des Pfortaderverlaufs mit einem Draht auf dem Bauch. Sie hilft die Pfortader zu treffen.
3. Schritt: Punktion der Vena jugularis interna und Einführung eines Katheters unter Durchleuchtung in die rechte Lebervene. Danach wird eine vorgebogene Nadel eingeführt, die in Richtung der Markierung, die im 2. Schritt auf den Bauch gezeichnet wurde, geführt wird.
4. Schritt: Durch Aspiration wird dann festgestellt, ob die Pfortader in der Leber getroffen wurde. Zugleich wird eine Portographie zur Kontrolle durchgeführt.
5. Schritt: Wenn ein Pfortader-Hauptast getroffen wurde, wird ein Führungsdraht und dannach ein sogenannten Distanzkatheter in die Pfortader vorgeschoben.
6. Schritt: Nun wird der Kanal im Leberparenchym, der zuvor geschaffen worden war, mit einem Ballonkatheter gedehnt, wozu man den sog. Palmaz-Stent benutzt.
Schweizer berichtete mir, dass sie Glück hatten, denn die Prozedur gelang, war jedoch außerordentlich schwierig und dauerte fast drei Stunden. Aber: Schott und Schweizer sagten trotz gelungener Prozedur im selben Moment: Das war das erste und wahrscheinlich auch das letzte Mal, dass wir zu diesem Verfahren greifen“. Trotz dieser Skepsis soll das technische Verfahren des TIPSS hier erklärt werden, da es inzwischen dank besserer Sonogarfiegeräte in vielen Kliniken zur Routine geworden ist. Die (Abb. 10) kann den technischen Verlauf erklären.
1.Schritt: Transjuguläre Katheterisierung der rechten Lebervene. Einlegen eines sog. Distanzkatheters.
2.Schritt: Vorführen der modifizierten sog. Rossnadel durch den Distanzkatheter und Punktion eines ultraschallmarkierten intrahepatisch gelegenen Hauptastes der Pfortader.
3.Schritt: Stabilisierung des Punktionsweges mit einem steifen Führungsdraht.
4. Schritt: Einführen des Palmaz-Stents über den Führungsdraht und Dehnung des Stents.
Postprozeduraler Verlauf nach TIPSS bei der 9-jährigen Isabella: Es dauerte 4-6 Tage bis die Blutung aus dem Ösophagus vollständig sistierte. Eine Endoskopie des Ösophagus 8 Tage nach der TIPSS-Anlage zeigte den Rest eines geplatzten Blutgefäßkonvoluts im unteren Ösophagus, jedoch auch eine beginnende Epithelialisierung der Schleimhaut. Isabella wurde am 9. Tag nach der Prozedur entlassen. Eine halbjährliche Nachuntersuchung bis ins 4. postprozedurale Jahr ergab keine Komplikation und keine unauffälligen Leberwerte. Selbst eine mäßige vorübergehende Erhöhung des Ammoniakwertes war dauerhaft verschwunden.
Fazit: Trotz dieses Erfolges mit einem TIPSS favorisierte Schweizer danach den Spleno-renalen Shunt, weil der TIPPS auch rund drei bis vier Stunden dauert, also im Vergleich zum Spleno-renalen Shunt keinen zeitlichen Vorteil bringt. Zudem ist das Risiko eines Spleno-renalen Shunts geringer, weil das Operationsfeld übersichtlicher ist. (Heute sind die Sonografiegeräte jedoch ausgereifter, sodass sie dreidimensionale Bilder produzieren können, wodurch die Übersichtlichkeit bei einer TIPSS-Anlage wesentlich besser und das Risiko geringer ist). Diese TIPSS-Anlage verbuchten wir trotz aller Schwierigkeiten als Premiere im Blick auf die Forschung, denn wir hatten Neuland betreten, auch wenn wir uns präzise auf die Prozedur vorbereitet haben. Wir konnten damals das Vorgehen gegenüber pädiatrischen Kollegen rechtfertigen, indem wir auf die Hartnäckigkeit des Mädchens hinwiesen und sich die akute Situation der Blutung bald nach der Aufnahme der Patientin deutlich verbesserte.
Fünftes Beispiel
(Geschehen in Hannover)
An einem frühen Freitag-Abend brachten die Sanitäter einen 6-jährigen Jungen in die Klinik, der sich auf einem Bauplatz seine rechte Hand knapp oberhalb der Wachstumsfugen an der Speiche und Elle an einer Kreissäge abgesägt hatte. Die Sanitäter hatten die massive Blutung zum Stehen gebracht, indem sie ihm den Arm mit einem Hemdsärmel abgebunden haben, den ein Sanitäter geopfert hatte.
Vom ärztlichen Personal war an diesem Freitag-Abend nur noch Schweizer und die diensthabende Ärztin Dr. Haase in der Klinik, die aber als diensthabende Ärztin nicht stundenlang am OP-Tisch stehen durfte, denn sie hatte andere Aufgaben. Das Personal war also knapp. Deshalb ließ Schweizer seinen Oberarzt Dr. Hannes Kolb in die Klinik rufen, um einen Assistenten zu haben.
Die Hand hatten die Sanitäter aber nicht mitgebracht.
Das Dilemma: Nachdem der junge Patient in Narkose gelegt worden war, musste Schweizer selbst an die Versorgung der Verletzung gehen, weil 5 Krankenhäuser mit Spezialabteilung für Hand- und Transplantationschirurgie eine Verlegung aus Personalnot abgelehnt hatten. Ein Handchirurg aus Tübingen, dem Schweizer den Jungen zur Versorgung schicken wollte, lehnte mit dem Hinweis ab, dass ein Transport von Hannover nach Tübingen zu lange dauern werde, was fürs Implantat schädlich sein könnte.Schweizer kannte ihn und er kannte Schweizer. Er wies darauf hin, dass er die Techniken doch gelernt habe und gewiss erfolgreich durchführen kann.
Da die Hand nicht mitgeliefert worden war, schickte Schweizer die Sanitäter zur Unfallstelle zurück, um die Hand zu suchen. Sie fanden sie auch in einem Sägemehl-Haufen und brachten sie in den OP.
Sein OA Dr. Kolb wurde mit der Reinigung der Hand beauftragt und er säuberte in dieser Zeit zusammen mit einer OP-Schwester den schmutzigen Armstumpf: Danach glättete er die Strumpfenden der Knochen, Sehnen und Gefäße. Dieser Säuberungsakt führte zur Erkenntnis, dass die Hand wenige mm oberhalb der Wachstumsfugen abgetrennt worden war, jedoch keineswegs mit glatten Wundrändern.
Nach dem diese Reinigungsarbeiten an der Hand und am Unterarm durchgefürt waren, makierte Schweizer die elastisch zurück geschnurrten Muskeln des Armes, die ebenso verkürzten Nerven und Sehnen mit verschiedenfarbigen Fäden.
Danach glättete er mit einer Säge die Ränder an den Unterarmknochen und am handnahen distalen Teil der Elle und Speiche mit den Wachstumsfugen. Elle und Speiche, sowie das handnahe Teil dieser Knochen, wurde dann jeweils mit einer Drittelrohrplatte unter Schonung der Wachstumsfugen und der handnahen Gelenkplatten stabilisiert.
Schweizer nähte danach mit feinen Fäden mirkrochirurgisch die passenden Enden der rechten und linken Armarterien und -venen zusammen, was viel Zeit in Anspruch nahm. Nach der Abnahme der Drosselung der Blutversorgung am Oberarm musste er noch ein paar Lecks mit weiteren Nähten verschließen. Nun konnten sie einen Puls am Handgelenk tasten und ein paar Minuten später auch feststellen, dass die Hand mit sämtlichen 5 Fingern gut durchblutet wurden.
Jetzt mussten Schweizer und sein Team noch mit viel Geduld die zusammenpassenden Nerven, Sehnen und Muskeln identifizieren und anastomsieren.
Als alle diese Prozeduren erledigt waren machten sie ca. 10 Minuten Pause, um die Durchblutung der Hand und Finger zu beobachten. Erst, als sie Gewissheit von einer guten Durchblutung hatten, nähten sie locker die häutigen Muskelscheiden, spülten das Operationsfeld mit einer desinfizierenden Flüssigkeit und schlossen die Hautwunde locker. Nach dem Anlegen eines nicht-komprimierenden Verbandes stellten sie den Arm im Ellenbogengelenk etwa auf 100 Grad abgewinkelt und das Handgelenk etwa um 15 Grad Beugestellung mit einem sanft anmodellierten Gipsverband ruhig.
Nun wurde Roland auf die Intensivstation verlegt. Der erste Schritt zur Versorgung einer außergewöhnlichen Verletzung war getan.
Jeden Tag kontrollierte Schweizer die Fingerspitzen mit Blick auf die Durchblutung mindestens 3-mal. Nach Auskunft der Schwestern gab es damals keinen Abend, an dem er das Haus verließ, ohne vorher nochmals nach Rolands Finger geschaut zu haben. Am 10. Tag nach der Replantation wagte er es, den Verband abzunehmen. Mit dem Blick zum Himmel bedankte er sich für den Erfolg, denn es gab weder Hinweise auf eine Durchblutungsstörung, noch auf eine Infektion. Die Ruhigstellung in der Gipsschiene beließ er aber bis zum 21. Tag. Die Schwestern durften die Schiene unter Beobachtung zeitweise entfernen.
Mit dieser Schiene entließen sie Roland am 17. Tag mit dem Hinweis, dass er sich alle 5 Tage in unserer Poliklinik vorstellen muss.
Die Behandlung erklärte Schweizer erst für abgeschlossen, nachdem Roland weitere drei Wochen später bei einer Nachuntersuchung alle Finger fast vollständig bewegen konnte. 7 Wochen nach dem Unfall kam er in die erste Klasse der Volksschule und konnte seine Hand zum Schreiben Lernen mühelos benutzen. Die Krankengymnastik wurde aber ein halbes Jahr lang fortgeführt, nicht zuletzt, um den sehr wilden Roland unter Kontrolle zu haben. Wenn er nicht zu den vereinbarten Untersuchungen erschien, rief die Krankengymnastin konsquent seine Mutter an.
Fazit: Dieses Beispiel kann zeigen, dass Kinderchirurgie an Fall-geprägten Krankheiten lernen und wissenschaftlich brauchbare Erfahrungen machen kann. Sie benötigt dazu kein Labor und keine Statistiken, ihre wissenschaftlichen Erkenntnisse kommen den Patienten direkt und unmittelbar zugute (auch wenn es dafür keine Nobelpreise gibt.)
Sechstes Beispiel
(Der Klatskin-Tumor bei einem 6-jährigen Jungen)
Die Mutter eines Jungen, der am Tag seiner Klinikaufnahme seinen 6. Geburtstag feiern wollte, fühlte sich morgens nach dem Verlassen des Bettes nicht wohl und erbrach mehrmals. Die Mutter wollte ihn mit einem Bad aufmuntern, ließ die Badewanne mit warmen Wasser volllaufen, ging in die Küche, um die letzten Vorbereitungen fürs Fest zu tätigen. Als Gregor(Name wurde geändert) ihr zurief, dass er mit dem Baden fertig sei, nahm sie das vorgewärmte Handtuch und frottierte ihren Sohn ab. Plötzlich erschrank sie, denn sie hatte im rechten Oberbauch eine harte Schwellung bemerkt.
Schlagartig änderte sich nun das Leben Gregors und der Mutter. Statt an den gedeckten Geburtstagstisch zu sitzen, fuhren sie rasch und unangemeldet zum Hausarzt, der die Schwellung im Oberbauch korrekt als Tumor der Leber bezeichnete.
Unmittelbar danach folgte die Fahrt in die 30km entfernte Klinik nach Tübingen, in der Schweizer damals Leitender Oberarzt der Kinderchirurgie war. Als sie im Klinikum am Eingang zur Poliklinik vorbeikamen, verabachiedete sich der Arzt, der Nachtdiest hatte, von der Nachtdienst-Schwester. Er nahm sich jedoch Zeit, sich von der Mutter des Jungen ansprechen zu lassen und schrieb für sie noch eine Anforderung für den Radiologen aus, der eine Sonographie des Oberbauchs anfertigen musste.
Schweizer war zu diesem Zeitpunkt schon gewaschen im OP, denn er musste den gebrochenen und grotesk verschobenen Ellenbogen eines 8-jährigen Jungen operieren, der, noch schlaftrunken zu Haus auf der Treppe gestürzt war.
Als Schweizer schon den Bruch der Knochen nahe am Ellenbogengelenk operativ freigelegt hatte, kam ein Assistent der Klinik mit einem Sonographie-Streifen in den OP, denn er wollte seinem Oberarzt das Sonographie-Bild unbedingt zeigen. Das Bild zeigte ihm auf den Ersten Blick einen Lebertumor ungewöhnlicher Ausdehnung.
Nach der Operation des stark dislozierten Ellenbogenbruchs ließ er sich das Sonographie-Bild Gregors in den OP bringen. Das Bild zeigte ihm einen mehrhöckerigen Tumor, der vom Zwölffingerdarm und Magens in die Leberpforte und von dort in die gesamte Leber, sowohl in den rechten, als auch in den linken Leberlappen reichte. Der Tumor war an manchen Stellen randständig nur von schmalen Streifen des Lebergewebes umsäumt. Vom Sonographischen Befund her konnte er den eindeutigen Lebertumor weder als Hepatoblastom, noch als Hepatocelluläres Carcinom deuten. Zudem war auch die Verbindung des Tumors mit der Wand des Zwölffingerdarms und des Magens ungewöhnlich. Er ging deshalb mit dem Bild zum Radiologen, der sich aber auch nicht für eine bestimmte Tumorgattung aussprechen wollte. Der Radiologe bot aber an, sofort eine Röntgenaufnahme der Lunge und eine Übersichtsaufnahme des gesamten Bauches anzufertigen.
Diese diagnostischen Aufnahmen zeigten aber, wie Schweizer sagte (Gott sei Dank) keine Hinweise auf Metastasen.
Nun fuhr Schweizer in die Kinderklinik, um mit dem Onkologen der Pädiatrie über weitere diagnostische Möglichkeiten zu sprechen. Dem jungen Patienten wurde Blut für Laboruntersuchungen abgenommen, jedoch alle Parameter, die den Tumor hätten klassifizieren können, waren negativ, jedoch waren alle sogenannten Leberwerte erhöht.
Nach dieser Konferenz quälte sich (wie Schweizer sagte) mein Gehirn ab, denn er wollte partout eine Tumorklassifizierung finden. Er untersuchte jetzt den Jungen selbst, versuchte alle Befunde in Einklang zu bringen. Dabei fiel ihm auch auf, dass auf dem Sonogramm weder eine Gallenblase, noch ein gestauter Gallengang zu sehen waren. Sein Gehirn (so sagte er) war im Durcheinander gespeicherten Wissens plötzlich auf den Begriff des Klatskin-Tumors gekommen.
(An dieser Stelle soll nicht ausführlich über den Klatskin-Tumor gesprochen werden, aber am Schluss des Textes wird dieser Tumor von Schweizer charakterisiert).
Nun folgte ein ernsthaftes Gespräch mit der Mutter. Schweizer musste ihr mit den gewonnenen diagnostischen Bildern glasklar erklären, dass weder medikamentöse Therapie, noch Bestrahlungen für eine Heilung in Frage kommen, sondern nur eine ausgedehnte, sehr riskante, im Blick auf die Risiken nicht überschaubare Operation eine kleine Chance haben kann.
(An dieser Stelle muss erwähnt werden, dass damals noch nicht über ein Serum-Kohlenhydrat-Antigen (=CA) gesprochen und keine Immuntherapie diskutiert wurde).
Diese Mitteilung, das wusste Schweizer, muss der Mutter die Füße unter dem Boden wegreißen. Nach dieser schweren Information, war Schweizer froh als ein Telefonat aus dem OP die nächste Operation angekündigte. Bevor er jedoch in den Op ging,rief er aber noch persönlich die Kindergärtnerin der Klinik an, die sich um die Mutter kümmern sollte, denn er kannte ihre psychologische Fähigkeit, Gespräche mit den Müttern zu führen, um Trost zu spenden.
Weitere Gespräche mit der Mutter und dem Personal der Klinik-Abteilung machten schon den nächsten Tag zum Operationtermin. Schweizer berichtete weiter, dass er am Abend des Tages am Telefon gesessen sei, um mit einem amerikanischen Kollegen, Daniel Hays in Los Angeles, zu telefonieren, den er auf einem Kongress kennengelernt hatte. Daniel Hays hatte ihm bei diesem Treffen gesagt, dass er sich auf kinderchirurgische Onkologie spezalisiert habe, weil die Tumorchirurgie in der Kinderchirurgie wegen spezifischer Merkmale gebündelt werden müsse. In diesem Telefonat ging es hauptsächlich um die Frage, wie viel Lebergewebe geopfert werden darf, um trotzdem das Leben zu erhalten. Anders ausgedrückt hieß die Frage: Wie viele Leber-Segmente erhalten werden müssen, um das Überleben des Patienten zu gewährleisten, denn er musste Hays sagen, dass bei seinem Patienten kein Leber-Segment eindeuig tumorfrei ist. Hays, (so sagte Schweizer) habe ihm keine konkrete Anwort geben können, vielmehr habe er wort-wörtlich gesagt: In deiner Haut möchte ich jetzt nicht stecken, denn du hast nur die Wahl, den Bauch zu öffnen und kritisch zu schauen, was zu erhalten ist. Danach musst du aber eine kühne Entscheidung auf Leben oder Tod treffen.
Nach diesem Telefonat setze sich Schweizer die halbe Nacht vor seine Bücher und plante, die Sonographie-Bilder respektierend, das Vorgehen bei der schon terminierten Operation. In seinem Kopf arbeitete die Frage weiter: Wie viel Leber-Segmente muss ich erhalten?
Wenige Stunden danach begann die Operation.
Der Tumor war zwar mit dem Zwölffingerdarm und Magen verwachsen, ließ sich jedoch im Gesunden durch Resektion eines Wandteils des Magens lösen. Danach inspizierte Schweizer von allen Seiten her die Leber mit ihrem Tumor. Er erkannte dabei die Wahrscheinlichkeit, dass der linke Leberlappen mindestens ein tumorfreies Segment hat. Dieses Segment präparierte er mit großer Sorgfalt und großem Respekt frei. Es war das Segment II (siehe Abb. 11), und es war nicht mit dem Zwerchfell verwachsen. Vom Segment II her suchte er, sich an der Vorderwand des Segment II orientierend, das kleine Segment I. Deses Segment erschien ihm auch tumorfrei, ebenso das obere Drittel des Segment III. Der untere Teil des Segments III war dagegen am unteren Rand und an der mittleren Berandung zum Ligamentum falciforme hin fest mit dem Tumor verwachsen.
(Damit sich der Leser dieser Befunde ein Bild von den Leber-Segmenten machen kann, wird in (Abb. 11) die Leber-Segmente dargestellt).
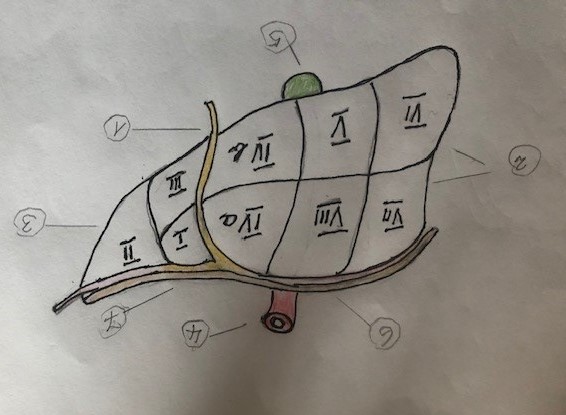 (Abb. 11)
(Abb. 11)
(Abb. 11): Nomenklatur zur Anatomie:
(1.) Ligamentum falciforme = Trennlinie des rechten vom linken Leberlappen durch eine mit der Bauchwand verwachsene Gewebsduplikatur.
(2.) Rechter Leberlappen mit 6 Segmenten.
(3.) Linker Leberlappen mit 3 Segmenten.
(4.) Vena cava inferior = Unterere Hohlvene, in die 3 hepatische Venen der Leber drainieren.
(5.) Gallenblasen-Bett. (6.) Zwerchfell.
(7.) Kraniale Verbindung des Ligametum falciforme zum Zwerchfell.
(Hinweise zur Anatomie und Chirurgie der Lebersegmentierung: Viele Autoren (besonders der Chirugie) zählen aus Gründen der Blutversorgung der Segmente die Segmente I-IV zum linken und die Segmente V-VIII zum rechten Leberlappen. Die Grenze zwischen dem rechten und dem linken Leberlappen ist dann die Linie vom Bett der Gallenblase (in der Abb. grün angefärbt) bis zum Rand der Vena cava inferior (in der Abb. rot angefärbt). Man muss daher zwischen einer anatomischen Lappenzuweisung und einer chirurgischen unterschieden. Chirurgen nennen diese Grenze den Sulcus medialis. Das Ligamentum falciforme trennt also den rechten vom linken Leberlappen nur nach der anatomischen Nomenklatur, nicht nach der chirurgischen. Chirurgen trennen nach dem Kriterium der Blutversorgung. In dieser Hinsicht verläuft die Trennlinie ventral zur Bauchdecke, bildet kranial eine Verbindung zum Zwerchfell und vereinigt sich kranial auch mit dem Ligamentum teres hepatis, das bis ins Nabelgewebe reicht. Anatomen nennen diese Verbindung die Chorda venae umbilicalis. Die Blutversorgung der Leber ist sowohl Aufgabe der A. hepatica als auch der Pfortader. Venös drainiert die Leber ihr Blut über eine rechte, mediane und linke Vena hepatica direkt in die Vena cava inferioor = in die untere Hohlvene.)
Dann mobilisierte Schweizer den großen rechten Leberlappen mit dem Tumor aus seinen Verwachsungen mit der Umgebung, wobei er sich bemühte, im gesunden Gewebe zu präparieren. Er begann mit der Lösung aus den Verklebungen des rechten Leberlappens am oberen Pol der rechten Niere. Danach arbeitete er sich nach oben und dorsal des rechten Leberlappens bis zum Zwerchfell vor. Die Präparation war zwar schwierig, (sagte er), gelang aber komplett, sodass er nach der Lösung des Konglomerats vom Zwerchfell die untere Hohlvene finden konnte.
Nach diesen Schritten der Präparation suchte er Schrittchen für Schrittchen die drei Lebervenen, die in die untere Hohlvene mündeten. Dabei führte ihn die Präparation bis zum Ligamentum falciforme, das den rechten vom linken Leberlappen anatomisch trennt. Eine gründliche Inspektion zeigte eindeutig, dass von den 6 rechten Lebersegmenten kein einziges Segment tumorfrei sein konnte. Es waren die Segmente V, VI, IVa und IVb, sowie die Segmente VII und VIII. (Abb. 11) zeigt schematisch die 8 Segmente der Leber. Die drei Segmente des linken Leberkompartiments (= links des Ligamentum falciforme liegend) waren nicht oder nur teilwiese vom Tumor infiltriert: Das Segment II und das Segment I waren makroskopisch beurteilt tumorfrei, das Segment III zeigte jedoch, dass die untere Hälfte eindeutig infiltriert war. Es war nun klar, dass nur das sehr kleine Segment I und das etwas größere Segment II tumorfrei waren, also erhalten werden konnten. Dabei hatte ich nirgendwo in der Literatur einen Hinweis gefunden, wieviel Leber unbedingt fürs Überleben notwendig ist. Und der Tumorexperte Daniel Hays hatte mir auch keine Antwort geben können.
(Nun fragte er sein Gewissen, ob er bei dieser unfreundlichen Konstellation überhaupt weiterpräparieren darf. Er konnte sich schließlich nur auf das Segment II und fraglich auch auf das Segment I verlassen. Sein Gewissen sagte ihm: Mach weiter, der Patient ist noch jung, wenige gesunde Reste der Leber können den Verlust kompensieren).
Trotzdem blieb ein quälender Rest Zweifel zurück, der jedoch beseitigt werden konnte, weil die Erfolge der Lebertransplantation damals wahrlich noch nicht „rosig“ waren, (wie ihm der Transplantationschirurg gesagt hatte). Aber: Er wusste auch, dass er absolutes Neuland, mit einer Resektion betreten muss, weil er nur 1 1/2 Segmente der Leber hinterlassen konnte. Wissenschaftliche Daten standen ihm nicht zur Verfügung. In dieser kritischen Lage wies ihn sein Gehirn auf Daten hin, die er zusammen mit seinem Doktoranden Kirschner für seine Promotion erarbeitet hatte: Leberzellen in Kulturmedien proliferierten rasch und bildeten Zellnetze. Schweizer baute nun auf die Wahrscheinlichkeit, dass (wenige) Leberparenchymzellen den Verlust rasch kompensieren können. (Die OP-Schwester Mariluise sagte ihm nach der Operation: Sie sagten fast unhörbar vor sich hin: Mit Gottes Hilfe: Und, (so sagte er im Interview), er habe damit sagen wollen, dass sein Gehirn ihm mit Gottes Hilfe den richtigen Weg gezeigt habe.)
Ich kürze nun den Bericht ab!
Auf Kirschners Ergebnisse und das Alter des Patienten baute Schweizer nun seine wohlüberlegte, kritische, rationale Entscheidung. Diese beiden Daten waren für ihn feste = verlässliche Daten, auch wenn es keine schriftlichen wissenschaftlichen Berichte gab. Er operierte nach diesen Überlegungen (mit Mut) weiter, denn diese beiden Daten waren seine wissenschaftlich orientierten Argumente fürs Weiterpräparieren.
Ich kürze nun den Bericht ab!
Schweizer resezierte also in typischer Art und Weise den gesamten rechten Leberlappen unter penibler Schonung der den linken Leberlappen versorgenden Blutgefäße der Leber, besonders der linken Vena hepatis. Mit dem Konglomerat des rechten Leberlappens wurde auch der größte Tumoranteil der Leberpforte einschließlich der Gallenblase mitentfernt.
Nach dieser gewagten Resektion ging alles nur noch um die Wiederherstellung der Blutgefäße des linken Leberlappens: Der Vena hepatica, der Arteria hepatica sinistra und des Pfortaderastes, der zum linken Leberlappen führt. Sekundäre, aber trotzdem lebenswichtige Bedeutung hatte auch die Wiederherstellung des Gallengangs, der Galle aus den linken Segmenten der Leber drainieren musste.
Es war klar, dass die linke Vena hepatica erhalten werden musste. Es war auch klar, dass der Stumpf der linken Arteria hepatica, den er erhalten hatte, durch eine Gefäßprothese mit einer Arterie des Magens anastomosiert werden musste. Zudem war auch klar, dass die unterbrochene Pfortader wieder prothetisch überbrückt werden musste. Diese Überlegungen hießen zusammengefasst, dass Schweizer drei Gefäßanastomosen bilden musste.
Die Rekonstruktion der Galleableitung über den Stumpf, der aus dem linken Leber-segment ragte, durfte auch nicht vergessen werden.
Zunächst entnahm er aus der linken und rechten Beinvene ausreichend lange Gefäßsegmente, mit denen er eine neue Arteria hepatica sinistra und eine neue linke Pfortader rekonstruieren konnte. Nach diesen zwei Gefäßanastomosen wurde der Stumpf des linken Gallengangs an eine Dünndarmschlinge des Jejunums angeschlossen.
Nach diesen Prozeduren machte das Operationsteam 7 Minuten lang Pause, um die Durchblutung der Leber mit ihren Anastomosen beobachten zu können. Nach diesen 7 Minuten hatte Schweizer den Eindruck, dass die Restleber, die jetzt nur noch aus 1 1/2 von ursprünglich 8 Segmenten bestand, ordentlich durchblutet wird. Zudem konnten wir einen Blutstau in der linken Vena hepatica ausschließen.
Von diesem Moment an blieb uns nichts mehr übrig, als den Verlauf akribisch und geduldig abzuwarten, (sagte Schweizer im Interview). Er wies aber auch darauf hin, dass sein Schlaf in den folgenden Tagen zerstückelt war und er froh sein konnte, wenn er zu Operationen abgerufen wurde, weil er sich dann eine Zeit lang auf andere Eingriffe konzentrieren musste. „Man nennt ein solches Leben stressig, sagte ein Kardiologe, der ihm erklären wollte, warum er selbst ausgefranzte Herzklappen implantiert, bekommen musste.
Am vierten postoperativen Tag fiel Schweizer nach eigenen Worten ein Stein vom Herzen: Ein Dopplersonogramm gab ihm den Hinweis, dass die Leber ordentlich durchblutet wird und die Laborwerte zeigten keinen gefährlichen Hinweis auf Störungen der Leberfunktion, insbesondere war der Wert des Ammoniaks und des Bilirubins stabil und fast normal.
Was ist nun ein Klatskin-Tumor? (Nun folgen ein paar Hinweise auf die Art des Tumors, den man im chirurgischen Jargon „Klatskin-Tumor“ nennt. Ein Klatskin-Tumor ist ein extrahepatisch in der Gallengangsbifurcation beginnender bösartiger Tumor, der früh in die Segmente des Leberparenchyms einwächst und auch früh in regionalen Lympfknoten nachgewiesen werden kann. Man nennt den Tumor im Fachjargon auch „Cholangiokarcinom, abgekürzt CCA. Er beginnt vorwiegend in der Bifurkation der beiden Gallengänge. Manche Pathologen nennen den Entstehungsort auch den Ductus hepaticus communis. Histologisch besteht der Tumor aus spezifischen Gallengangsepithelien, die man auch Cholangiocyten nennt.)
Fazit: Zurzeit als Gregor wegen eines solchen Tumors operiert werden musste, war das operative Vorgehen die einzige therapeutische Maßnahme, die angeboten werden konnte. Die Überlebenszeiten waren noch sehr gering. Inzwischen werden auch Immuntherapien diskutiert und angeboten, die sich auf das Antigen Serum-Kohlenhydrat-Antigen beziehen. Endgültige Aussagen zur Überlebenszeit und damit der besten Therapie gibt es noch nicht, zumal es sich um einen seltenen Tumor handelt.
Wenn nun jemand nach Gregors Schicksal fragt, dann können wir nur sagen, dass er im Alter von 51 Jahren (nach Berichten von Menschen, die ihn kannten) an einem Glioblastom des Gehirns starb, das in Südafrika operiert worden war, wohin er ausgewandert war. Dort starb er 4 Monate nach der Operation an einem Glioblastom-Rezidiv. (Telefonische Aussagen).
Seine Leber hatte sich schon ein halbes Jahr nach der erwähnten radikalen Operation erholt, war in Größe und Form weitgehend normal. Wahrscheinlich konnten wir Gregor operieren, bevor sein Klatskintumor in Lympfknoten metastasierte, obwohl er brutal in die Lebersegmente eingewachsen war.
(Zu vermerken ist noch, dass der Name des Patienten auf Wunsch der Eltern ausdrücklich geändert werden musste).
(Die bisher genannten Beispiele wurden ausgewählt, weil sie zeigen können, dass Forschung nicht nur in Labors, sondern auch in den Köpfen von Chirurgen akut stattfinden muss, dass Daten oft akut rational durchdacht werden müssen, damit eine Operation schwieriger Gattung zum Ende gebracht werde kann.)
Siebtes Beispiel
(Der nur 620 Gramm wiegende Winzling (wie das Kind von Schwestern genannt wurden).
Eine wiedersprüchliche Entscheidung!)
Die Ärzte und Schwestern der Neonatologieschen Abteilung der Kinderklinik auf der Bult in Hannover, wo Professor Paul Schweizer Chefarzt der Kinderchirurgie war, kämpften um das Überleben eines zu früh geborenen Mädchen, das 620g wog und einen offenen Ductus Botalli hatte.
Ein Ductus Botalli ist für das ungeborene Kind ein Vorteil, weil das Blut aus dem rechten Ventrikel des Herzens nicht durch die Gefäße in der Lunge gepumpt werden muss, sondern über ein Kurzschlussgefäß, sofort unter Umgehung des Lungenkreislaufs in die Aorta fließen kann. Dieses Kurzschlussgefäß zwischen der Arteria pulmonalis und der Aorta nennt man Ductus Botalli. Dieser Kurzschluss im Kreislauf ist im embryonalen Leben sinnvoll, denn im Fruchtwasser ist keine Atmung möglich, würde fatal enden. Diese Situation endet abrupt mit dem Ersten Schrei und dem ersten Atemzug des Kindes, wenn sich aus physikalischen Gründen die Kurzschlüsse im Gefäßsystem schließen.Jetzt kann und soll das Blut aus dem rechten Ventrikel zur Oxygenierung in den Lungenkreislauf fließen. Bei reif geborenen Kindern wird der Ductus Botalli auch im Ersten Schrei und dem Ersten Atemzug physikalisch als Folge der Druckverhältnisse geschlossen, bei zu früh geborenen Kinder jedoch oft nicht.
Nun versuchen Ärzte der Neonatologie den Ductus medikamentös zu schließen, was manchmal gelingt, oft jedoch nicht. Beim Misslingen muss das Kind mit nahezu 100%-igem Sauerstoff beatmet werden, was zur Erblindung führen muss.
Wenn es nicht gelingt, den Ductus medikamentös zu schließen, dann ist der Kinderchirurg oder Kinderkardiologe gefragt.
Und nun die Geschichte:
Enrike (so wurde der Winzling der Neonatologie genannt) kam blau zur Welt, sodass rasch erkannt werden konnte, dass das Mädchen einen offenen Ductus Botalli hat. Eine medikamentöse Schließung wurde zwar rasch in die Wege geleitet, aber versagte total.
Nun kommt die extreme Frühgeburtlichkeit und die Folge der medikamentösen Therapie ins Spiel: Bei der extremen Frühgeburtlichkeit und der therapiebedingten Beatmung mit 100% Sauerstoff erblindete das Kinder außergewöhnlich rasch.
Nachdem wenige Wochen zuvor in der Medizinischen Hochschule Hannover (= MHH) ein ebenso frühgeborenes Kind mit 750 g von Kardiologen auch an einem Ductus Botalli operiert worden war, jedoch bald nach der Operation verstarb, entschied sich die Ethikkommission, an der Ärzte und Schwestern unserer Klinik und der MHH teilnahmen, nolens volens nach einem Gespräch mit den Eltern, das Kind nicht zu operieren, sondern es sterben zu lassen. Die extreme Frühgeburtlichkeit, die Erblindung und der Hinweis auf den Tod des frühgeborenen in der MHH waren entscheidende Argumente für diese Entscheidung. Von den Teilnehmern der Konferenz hatte (soweit Schweizer erfahren konnte) niemand daran geglaubte, dass das Kind eine Operation überleben kann. Die Blindheit war zwar kein entscheidendes Argument für die Entscheidung, konnte als Argument aber nicht ausgeschlossen werden.
Nun kam ein Zufall und eine Formulierung von mir ins Spiel, die ich von meinem früheren Chef Flach in der Kinderchirugie gelernt habe.
Auf der Treppe des Hauses begegnete der leitende Oberarzt der Neonatologie dem Kinderchirurgen Schweizer. Sie bergüßten sich und Schweizer sprach ihn
unumwunden auf sein blasses Aussehen an, das zudem Überforderung ausdrückte. Der neonatologische Oberarzt kam sofort auf die Entscheidung der Ethikkonferenz zu sprechen, von der Schweizer gar keine Notiz bekommen hatte. Der Neonatologe kam direkt nach dem Ende der Konferenz die Treppe herunter und berichtete noch unter dem Eindruck der Entscheidung von dem Votum fürs Sterbenlassen des Kindes aus guten Gründen (wie er sagte). Er schloss seinen Hinweis mit der Frage: Wie hätten sie denn votiert? Und Schweizer sagte (so wurde mir berichtet): Ich bin Chirurg und wurde von meinem früheren Chef so geprägt, dass wir Ärzte alles für das Überleben eines Patienten tun müssen, was möglich ist. Leben erhalten ist unsere Aufgabe, sagte sein Chef nicht Leben beenden.
Im selben Augenblick rannte der Neonatologe zu Schweizers Überraschung wortlos die Treppe hoch. Schweizer ging sehr überrascht zur Sprechstunde in den Ambulanzraum.
Zehn Minuten später kam der Neonatologe mit roten Kopf und nach Atem ringend wieder zurück und sagte überraschend: Wenn sie bereit sind, dann können wir Enrike in einer halben Stunde operieren, mein Chef und die Eltern haben bereits zugestimmt.
Schweizer war einverstanden, nahm den Telefonhörer ab und rief die Anästhesistin an, um sie zu informieren. Frau Dr. A. (eine ausgezeichnete Anästhesistin) lehnte aber eine Narkose ab und verwies auf das Votum der Ethikkommision. Der Neonatologe vereinbarte mit Schweizer aber, dass das Kind schon intubiert sei und er sich zutraue, eine Narkose zu steuern.
Schweizer verständigte sofort die OP-Schwestern und den Saalpfleger und rief einen Assistenten an, der ihm assistieren musste.
Eine halbe Stunde später lag das Kind auf dem OP-Tisch und die Operation konnte beginnen. Schweizer öffnete (so berichtete er mir) die linke Thoraxwand des Winzlings mit einem 2 cm langen queren Schnitt, spreizte die Thoraxwand und forderte absolute Ruhe im Saal. Dann verlangte er eine schmale, aber lange stumpfe Pinzette und eine Schere. In wenigen Sekunden hatte er den Ductus gefunden, weil das Kind als Frühgeborenes wenig Fett im Gewebe hatte. Nun verlangte er einen schmalen Overholt, um den höchstens 1 cm langen Ductus zu unterfahren. Die OP-Schwester berichtet mir, dass Schweizer mit minimalen Bewegungen präparierte, um die Hinterewand des Ductus zu lösen. Später sagte er ihr, dass er hochkonzentriert präparierte, weil die Wand des Ductus so dünn war, das er die Blutkörperchen durch das Gefäß fließen sah. Es dauerte zwei bis drei Minuten, bis er die Hinterwand gelöst hatte und den Ductus mit zwei geflochtenen Fäden am Overholt unterfahren konnte. Dann kam die nächste Anstrengung. Er musste jeden Faden um den höchstens 1 cm langen Ductus knoten und zusätzlich zwischen den beiden Fäden noch Platz lassen, um den Ductus dazwischen zu durchschneiden. Zudem musste er ständig das Einschneiden der Fäden in die Wand des Ductus vermeiden.
Damit er die Fäden knoten konnte musste er den Overholt und eine lange Pinzette benutzen und mit diesen beiden Instrumenten behutsam in der Tiefe die Fäden ohne Sicht knoten.(Schweizer erklärte mir später, dass er seine Hand nicht in den kleinen Thorax führen konnte). Die OP-Schwester sagte, dass die Phase dieser Prozeduren gespenstig gewesen seien.
Dann, so sagte die OP-Schwester, habe er endlich stumm das Zeichen gegeben, dass er die Schere benötigt, um den Ductus zwischen den beiden Fäden zu durchtrennen. Als dieser Akt beendet war sei Schweizer mit der Schere in der Hand stumm und starr dagestanden bis er mir die Schere mit den Worten zurückgab: Gott sei Dank.
Nach dem Verschluss der Thoraxwand wurde Enrike vom Neonatologen und einer Schwester in das Intensivzimmer der Neonatologie gebracht. Ich ließ die Eltern in den Vorraum des OP's bringen, um ihnen von der anstrengenden Operation zu berichten.
Der postoperative Verlauf war von der Seite des chirurgischen Eingriffs aus beurteilt komplikationslos. Die Neonatologen hatten jedoch Mühe, das Kind zum Gedeihen und Wachsen zu bringen. Und, das darf trotz aller Euphorie nicht vergessen werden, es war fürs ganze Leben blind.
An ihrem 18. Geburtstag besuchte mich Enrike mit ihren Eltern in Tübingen. Sie war ein schönes, großes Mädchen geworden. Als Dank für die Operation, die nun 17 Jahre zurücklag, fiel sie mir scheu um den Hals und flüsterte mir wort-wörtlich ins Ohr; Ich danke dir mit Leib und Seele, ohne dich würde ich nicht leben, du bist für mich daher wie ein zweiter Vater. Dieser Satz ist eines der schönstens Geschenke meines Lebens.
(Nun stellte ich die Frage: Was für ihn der Begriff Wissenschatlichkeit bedeutet?)
Er antwortete mit 4 Hinweisen:
Erstens: Nach der Definition des Begriffes Wissenschaft in wissenschaftlichen Lexika's ist Wissenschaft (lat. = sciencia) Erkenntnisgewinnung durch Forschung.
Zweitens: Methoden zur Erkenntnisgewinnung sind (nach Schweizers Erfahrung) z.B.: Beobachtung, Datenmessung, rationale Abwägung, systemische angelegte Untersuchungen, logische Überlegungen zu kausalen Zusammenhängen, sowie Überlegungen und Wertungen zu Gesetzmäßigkeiten.
Drittens: Das Ziel der Wissenschaft ist die geordnete, logische, rationale Erkenntnis.
Viertens: Merkmale der Wissenschaft sind: *Ergebnisoffene Untersuchungen, *logische Gedanken, *folgerichtiger experimenteller Aufbau eines Programms,*die Widerspruchslosigkei, *die systematische, objektive Methodik und *die Reproduzierbarkeit.
Abhängig vom jeweiligen Forschungsgebiet hat solche Wissenschaft unterschiedlichen Charakter. In der Biochemie sind es z.B.: physikalische Elemente, berechenbare Reaktionen, in der praktischen Chirurgie sind es rationale, logische, widerspruchsfreie Überlegungen in der Planung und Durchführungs von Präparationen, wobei die Machbarkeit eine große Rolle spielt. Der Erfolg hängt trotz raffinierter technischer Verfahren in der Diagnostik oft von intraoperativ durchdachten Überlegungen ab, welche die Anatomie der Organe, die Funktion des Organs, die phsiologische Verträglichkeit und nicht zu letzt das Alter der Patienten rational betrachen muss. Dieser Katalog schließt Intuition nicht aus, denn intuitiv richtige Entscheidungen setzen breites, umfassendes, gründlich erworbenes, im Gehirn gespeichertes Wissen voraus. Das Gehirn kann (wie ein Computer) reale, logische Zusammenhänge erkennen, herstellen und zur Verfügung stellen, die jedoch gedanklich kontrolliert werden müssen. Input und Output müssen über einstimmen sagte ein Vertreter der KI.
Ein hervorragender und erfahrener französischer Chirurg sagte mir: Chirurgen müssen ihr Gehirn derart konditioniert und traniert haben, dass sie sekundenschnell durch umfangreiches Wissen reagieren können (Schweizer fügte hinzu): Lernen, lernen, lernen und Erfahrungen sammeln macht schließlich die Wissenschaftlichkeit des Chirurgen aus, er braucht dazu kein Labor, keine Statistik, sondern nur sein Gehirn.
Achtes Beispiel
(Das Schicksal eines 4-jährigen Buben, den ein großes umfallendes, schweres Scheunentor fast erschlagen hat.)
Gegen 20.00 Uhr wurde von einem auswärtigen Kinderkrankenhaus gemeldet, dass zu unserer Klinik ein Sanitätswagen mit einem 4-jährigen Buben unterwegs ist, den ein schweres, umfallendes Scheunentor niedergeworfen und fast erschlagen hat. Das Krankenhaus berichtete auch, dass er aus dem Mund und den Lippen stark blutet und große Schwierigkeiten beim Atmen hat.
Der Patient war ein blue baby (wie der auswärtige Arzt sagte), der den Transport des Kindes unserem Pförtner ankündigte. Er war sediert, blutete stark aus dem Mund und aus den Lippen, hatte ausgedehnte Blutergüsse über der Brustwand, dem Bauch, den Beinen und Armen, sein Gesicht war verschwollen und von Schürfwunden übersät. Er war im auswärtigen Kinderkrankenhaus zwar intubiert worden, kam bei uns aber ohne Tubus an.
Der Diensthabende Anästhesist und Schweizer waren vom Pfleger der Polyklinik informiert worden und schon im Notfallraum anwesend. Während der Anästhesist sich um eine Intubation bemühte, führte Schweizer eine erste Untersuchung durch und sonografierte den Bauch. Er konnte im Mund 3 ausgebrochene Zähne feststellen, hörte über der rechten, instabilen Brustwand, die auf mehrere Rippenfrakturen hinwies, nur „wässrige“ (=blubbernde) Geräusche, jedoch keine Atemgeräusche und bei der Sonographie des Bauches erkannte er keinen Hinweis auf eine Organverletzung.
Als er die rechte Seite der Lunge zwischen der 5. und 6. Rippe punktierte, spritzten Blut- und Luftblasen mit Druck aus der Brusthöhle. Er führte deshalb rasch durch die Stichstelle eine Thoraxdrainage in die Brusthöhle ein, aus der sofort unter Druck frisches Blut und Fontänen von Luftblasen strömten.
Ein stiller Wink mit dem Kopf in die Richtung des Anästhesisten und der OP-Schwester war das Zeichen, dass der Junge nun rasch in den OP gefahren werden muss. Der Pfleger hatte vorsorglich auch schon das OP-Personal informiert.
Ein Assistent und Schweizer wuschen sich rasch, während die Pfleger mit der Lagerung des Patienten auf dem OP-Tisch beschäftigt waren. Die Brusthöhle wurde nicht seitlich, sondern über dem Brustbein geöffnet, weil Schweizer auf eine ausreichende Übersicht wertlegte. Das Brustbein erwies sich als frakturiert und war rasch in seiner ganzen Länge durchtrennt. Dann war die Malaise übersichtlich zu erkennen: Der rechte Lungenflügel war an der Wand der Luftröhre komplett ausgerissen.
Die Lunge selbst wies zwar mehrere breite und dick-verschwollene Blutergüsse auf, war offensichtlich mit Blut gefüllt, zeigte aber keine äußeren Einrisse. Als erste Maßnahme bat Schweizer den Anästhesisten darum, den Tubus, den er in der Luftröhre sah und mit einem Overholt fassen konnte, in die linke Lunge umzulagern. Der Anästhesist zog den Tubus langsam zurück und Schweizer dirigierte ihn mit einem Overholt in den linken Hauptbronchus, aus dem der Anästhesist Blut absaugen konnte. Danach konnte er den Patienten viel besser beatmen.
Nun ging Schweizer daran, die ausgefranzten Ränder an der Trachea und dem Stammbronchus der rechten Lunge vorsichtig zu glätten. Danach nähte er zunächst die Hinterwand des Stammbronchus an die rückwärtsliegende Wand der Luftröhre. Als er mit seiner Naht zufrieden war, saugte er aus dem Stammbronchus der rechten Lunge Blut ab. Der Saalpfleger fragte hörbar: Wo hat Schweizer denn das Melken gelernt, denn er hatte das Blut aus der Lunge durch sanften Druck mit beiden Händen mehrmals hinausgedrückt. Danach nähte er auch die Vorderwand des Bronchus an die Wand der Luftröhre. Bevor die letzten Nähte gestochen waren, bat er den Anästhesisten, den Tubus gut zu fixieren. Nun blähte sich die rechte, verletzte Lunge allmählich auf, zeigte keine Lecks.
Nach der Säuberung der Brusthöhle und Einlage einer Thoraxdrainage wurden 3 gebrochene Rippen reponiert und periostal genäht. Dann konnte die Thoraxwand geschlossen werden.
Der 4-jährige Bube blieb 2 Tage lang sediert und mit schwachem Druck beatmet. Am 3. Tag extubierten wir ihn und konnten zu unserer Freude beobachten, dass Benedikt spontan zu atmen begann. Auch die rechte Lunge wurde benutzt.
Die Wunden im Gesicht, an der Brustwand, über dem Bauch, den Beinen und Armen, die zum Teil genäht werden mussten, heilten binnen 10 Tagen weitgehend problemlos ab. Benedikt konnte auch vom 5. postoperativen Tage an im Spielzimmer mit den anderen Kindern spielen und am 11. Tag nach dem Entfernen der Thoraxdrainage nach Hause entlassen werden.
Da er jedoch noch zaghaft und unregelmäßig atmete vereinbarten wir eine tägliche Nachuntersuchung im nahegelegenen Kinderkrankenhaus, um das freie Atmen wieder zu erlernen. Von dort wurde uns Benedikt 10 Tage später vorgestellt: Er war kerngesund.
Fazit: Ein kompletter Ausriss eines Lungenflügels aus der Trachea wurde, so ergab eine Studie eines Assistenten, in der medizinischen Literatur nicht beschrieben. Es handelt sich also um eine seltene Verletzung. Eine solche Verletzung benötigt im Blick auf eine Operation auch gar kein spezielles Wissen, denn wer die Anatomie beherrscht, wird ganz automatisch richtig handeln.
Entscheidend ist der zeitliche Aspekt, den das Beispiel ausdrückt. Der vierjährige Patient hatte schon bei der Aufnahme in unsere Klinik einen Hb-Wert von 3,6 g/dl, musste also viel Blut verloren haben. Und der systolische Blutdruck war mit 48 mmHg sehr niedrig. (Normwert HB: >12 g/dl, Normwert systolischer Blutdruck: ca. 90-100 mmHg).
Mit diesen niedrigen Werten ist die Gehirndurchblutung kritisch niedrig, es muss also rasch gehandelt werden. Ein solcher Patient muss in die nächste Klinik gebracht werden, wo sich ein Chirurg zutraut, eine Diagnose zu stellen und zügig zu operieren. Notfalls muss der Patient nicht zum Chirurgen, sondern der Chirurg zum Patienten kommen.
Im vorliegenden Fall dauerte es 2 Stunden, bis der Patient in ein Krankenhaus eingeliefert werden konnte und es dauerte nochmals rund 1 Stunde, bis er in unsere Klinik weitergeleitet wurde.
(Ausdruck für eine zu lange Dauer bis zum Therapieeintritt war die trockene Blase, wie sich beim Legen eines Blasenkatheters auf dem OP-Tisch herausstellte. Aus seiner Blase entleerte sich kein Tropfen Urin).
Fazit: Dieses Beispiel ist nicht für eine Premiere geeignet, da es ein seltenes Ereignis darstellt und keine außergewöhnliche Operation notwendig macht. Für den Patienten kann aber wesentlich = lebensrettend = gesundheitserhaltend sein, wenn er schnell in Hände kommt, die punktgenau die richtige Diagnose stellen und anatomiekorrekt handeln können.
Dieses Beispiel zeigt zudem wie sich das Leben eines Menschen von einer Sekunde auf die andere verändern kann, die Grenze zwischen dem normalen, alltäglichen Leben und dem Tod zusammenbricht. Als Chirurg sind wir nicht selten mit dieser Erfahrung konfrontiert. Chirurgen und der Notfalldienst müssen deshalb auch für solche Seltenheiten gewappnet sein, damit sie sofort sachgemäß = anatomie- und funktionsgerecht handeln können.
Neuntes Beispiel
(Eine Operation am Gehirn)
Der 14-jährige Klassenprimus eines Gymnasiums stieg aus Gründen über den Gartenzaun seines Nachbarn, die wir nie erfahren konnten. Dieser Gartenzaun war oben mit scharfen Spießen versehen, die jeden Menschen am Übersteigen des Zauns verhindern sollten. Thimo (der Name wurde geändert) wagte den Schritt über den Zaun jedoch, stürzte aber, als er sich über den Zaun schwingen wollte. Er fiel derart ungünstig, dass sich einer der Spieße in seinen Hals bohrte, den Kehlkopf exakt in der Mittellinie spaltete, sodass auch die Stimmbänder in zwei Richtungen auseinander gerissen wurden. Danach bohrte sich der Spieß durch die Schädelbasis, zersplitterte sie gründlich, ließ jedoch alle großen Blutgefäße intakt. Er schonte auch die Sehnerven, die oberhalb der Schädelbasis zu ihren Hirnarealen verlaufen. Dann trat er ins Gehirn ein, wo er in der Broca-Region mit seiner Spitze stecken blieb. Der Spieß war also in die fronto-basale Region des Gehirns eingedrungen, hatte jedoch zum Glück die Nasennebenhöhlen und die Orbita-Region nicht verletzt. (Abb. 12).
Die Übersicht war zunächst durch ausgedehnte Hämatome unübersichtlich, das Hirnparenchym war bis weit nach dorsal verschwollen, sodass auch die Wernicke-Region in die Schädigung miteinbezogen worden war.
(Nun muss ich darauf hinweisen, dass Gehirnchirurgie das Terrain der Neurochirurgen ist. Deshalb beauftragte ich meinen Oberarzt Dr. Kolb, den Neurochirurgen eines auswärtigen, jedoch städtischen Krankenhauses anzurufen. Es ging vor allem um eine Verlegung des Patienten in sein Krankenhaus. Der Neurochirurg erklärte die Verlegung in sein Haus mit dem Hinweis auf das enorme Risiko für nicht angebracht. Seine Zusage, sofort in unsere Klinik zu kommen, verzögerte sich indessen gewaltig, weil er wegen eines frisch eingelieferten Unfallpatienten mit einer Schädelverletzung gebunden wurde. (Nun ging die ganze Verantwortung nolens volens an uns über.))
Mein Gehirn repetierte nun stillschweigend arbeitend die Anatomie des Gehirns. Es arbeitete bestimmt ziemlich intuitiv.
Ein Röntgenbild des Schädels, das wir auf dem Op-Tisch anferigten, wies darauf hin, dass sich der Spieß bis ins Großhirn, vielleicht sogar bis in die Broca-Region, durchgestoßen hatte.
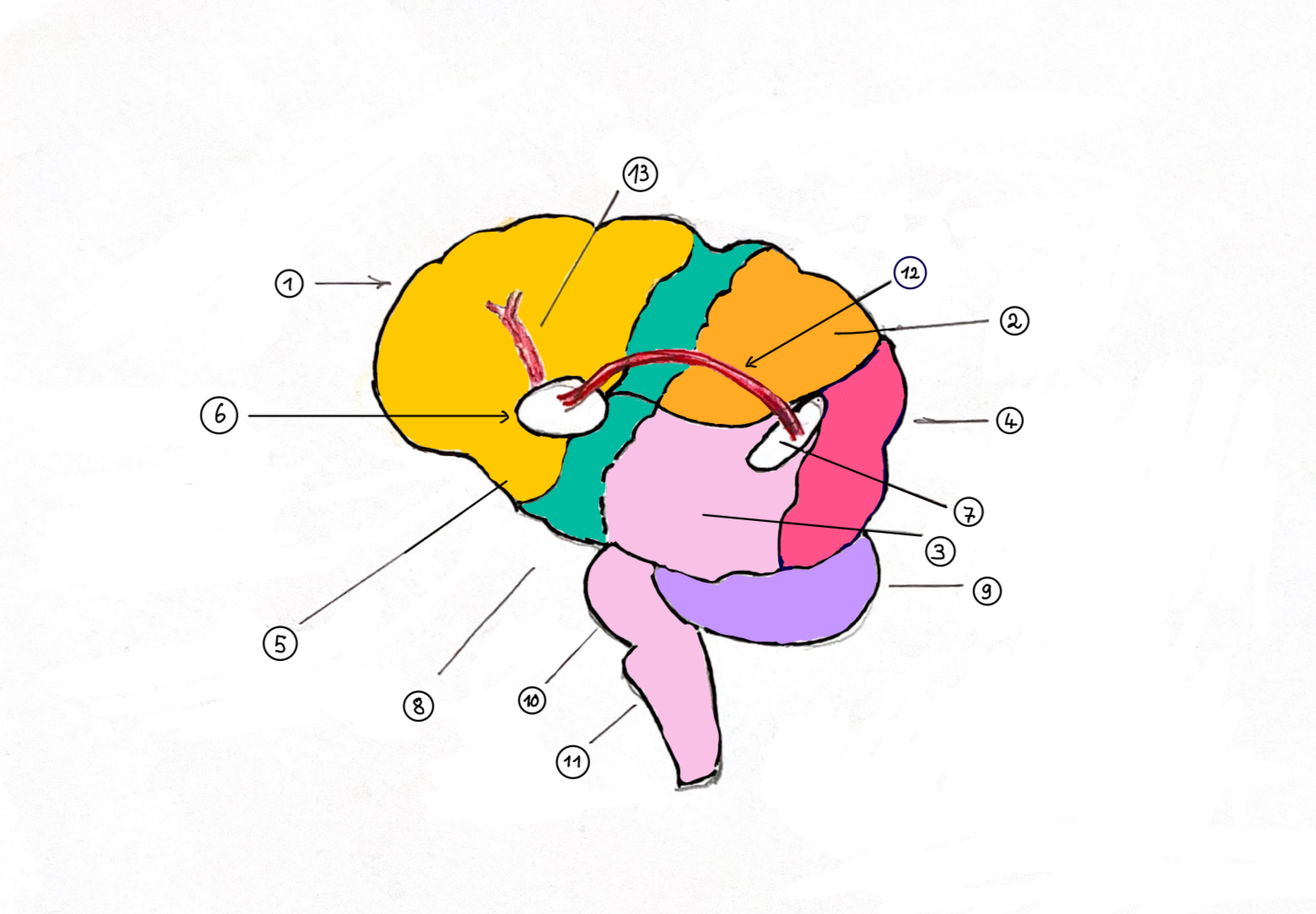 (Abb.12)
(Abb.12)1. Praefrontale Rinde, auch Frontallappen genannt
2. Scheitellappen
3. Schlaefenlappen
4. Hinterhaupt
5. Fronto-basale Region
6. Broca-Region
7. Wernicke-Region
8. Motorisches Zentrum
9. Kleinhirn
10. Pons
11. Medulla Oblongata= Vvrlaengerte Mark
12. Fasiculas arcuatus
13. Verbindung der Broca-Region mit dem Grosshirn
Zunächst deckte ich die Hämatome am Hals und in der sichbaren Schädelbasis mit feuchten, frisch desinfizierten Tüchern ab. Manche Stellen tamponierte ich weich, wenn der Verdacht bestand, dass sie aufbrechen könnten. Danach löste ich, mich streng an den Schaft des Spießes haltend, den Spieß vom Hirngewebebe. Ich wollte den Spieß nicht aus dem Hirnparenchym ziehen, bevor ich ihn nicht auf der ganzen Strecke sehen konnte. Sonst hätte ich vielleicht weiteres Gehirnparenchym verletzt. Während ich diesen Teil der Präparation ausführte, schickte ich meinen Oberarzt Dr. Kolb ins schon erwähnte Krankenhaus, um eine chirurgische Säge zu besorgen mit der ich die Spitze des Spießes absägen konnte. Für die Entfernung der beiden seitlichen Flügel der Spitze war die Säge aber ziemlich grob, sodass ich sie mehr oder weniger Stückchen für Stückchen abknabbern musste.
Nach dieser zeitraubenden Prozedur konnte der abgesägte Schaft und der noch im Gewebe steckende Teil der Spitze mühelos aus dem Hirngewebe entfernt werden.
Das Loch in den Windungen der Broca-Region war 2-3 cm lang und fingerbreit. (Im Augenblick, als der Schaft und die Spitze entfernt waren, kam der Neurochirurg durch die Tür des OPs. Er wusch sich, um sich einen Überblick über die Situation zu verschaffen, gab mir ein paar Hinweise zur Versorgung der Schädelbasis, klopfte mir auf den Rücken und sagte: Sie hätten eigentlich Neurochirurg werden sollen. Dann verließ er den OP wieder.)
Danach glättete ich die rauen Stellen im Loch der Schädelbasis, ließ die bereits genannten Hämatome im Parenchym in Ruhe, legte eine weiche Drainage auf die Schädelbasis, ohne die Sehnerven zu tangieren und widmete mich der Rekonstruktion des Kehlkopfes mit den Stimmbändern.
Die Stimmbänder mussten mit sehr feinen Fäden wieder an der Wand des Kehlkopfes befestigt werden, was mikrochirurgisch problemlos gelang. Obwohl die Wände des Kehlkopfes zwar bis hinten gespalten waren, gelang auch die Rekonstruktion des Kehlkopfes und des Zungenbeins ohne Probleme.
Nach der Einlage einer weichen Drainage in das Gebiet des Kehlkopfes wurde die Wunde des Halses schichtweise verschlossen und ein Kopfverband angelegt.
Fazit: Der Verlauf war vom technischen Ablauf her zwar gelungen, aber eine Untersuchung durch einen Neurologen bestätigte die erwartete Funktionsstörung der Broca- und der Wernicke-Region. Beide Regionen waren (wohl)durch Hämatome und Prellungen irreversibel geschädigt worden.
Ich war bei der neurologischen Untersuchung durch den Neurologen anwesend und musste erleben, dass mein Patient gemischte Aphasien hatten. Als der Neurologe mein Gesicht wahrnahm fasste er mich um die Schulter und sagte: Sie haben alles absolut richtig gemacht und können stolz sein, dass sie dem Buben das Leben gerettet haben. Trotzdem (fügte er noch hinzu) werde ich ihm einen Rehabilitationsplatz besorgen.
Der Junge war nach seiner Entlassung ein ganzes Vierteljahr in der Reha. Er lernte viele Worte zu sprechen, die jedoch nur von Menschen der unmittelbaren Umgebung verstanden werden konnten. Der Neurologe war der Meinung, dass er die Artikulation noch verbessern kann, wenn er wieder in seiner gewohnten Umgebung ist. Die Schule konnte der hochbegabte Schüler jedoch nicht mehr besuchen. Die Eltern sorgten für weitere Logopädie und konnten noch eine erkennbare Besserung der Aussprache und der Wortfindung erreichen, aber Satzbildungen blieben bis auf rudimentäre Reste aus.
Beide Eltern starben rund ein Jahr nach dem selbstverschuldeten Unfall ihres einzigen Sohnes, wahrscheinlich aus Gram über das fatale Schicksal.
Thimo wurde von seiner Schwester, die Uhrmacherin/Juwelierin/Goldschmiedin ist, in ihr Geschäft integriert. Er ist sehr talentiert und lernte rasch, wie man Schmuckstücke und Uhren reparieren kann (sagte sie) und fügte hinzu: Insofern ist er ein guter Mitarbeiter. Diese Auskünfte erhielt ich von der Schwester des Patienten, als ich etwa 3 Jahre nach dem Unfall mit ihr telefonierte.Am Ende dieses Telefonats sagte sie aber noch: Es tut trotzdem immer noch weh, was Thimo passierte.
Fazit: Menschen sind verletzlich, labil, vergänglich. Ihr vermeintlich sicheres Dasein kann von einer auf die andere Sekunde zusammenbrechen. Damit bewahrheitet sich der Satz, (dass Leben eben) Leiden ist. (Warum müssen sie leiden, fragen viele Menschen, bekommen jedoch nie eine plausible Antwort).